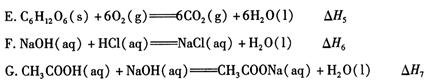��Ŀ����
��Դ�Ŀ����������������Ŀɳ�����չϢϢ��ء�
��.��֪��Fe2O3(s)��3C(s)=2Fe(s)��3CO(g) ��H1��a kJ��mol��1
CO(g)��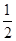 O2(g)=CO2(g)�� ��H2��b kJ��mol��1
O2(g)=CO2(g)�� ��H2��b kJ��mol��1
4Fe(s)��3O2(g)=2Fe2O3(s)�� ��H3��c kJ��mol��1
��C��ȼ���Ȧ�H��________ kJ��mol��1��
��.(1)����ԭ��صĹ���ԭ�������л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���________(�����)��
A��C(s)��CO2(g)=2CO(g)
B��NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)
C��2H2O(l)=2H2(g)��O2(g)
D��2CO(g)��O2(g)=2CO2(g)
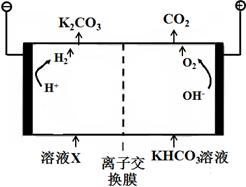
�������ڵ�K2CO3��CO2Ϊ��Ӧ�Ļ�����������ѡ��Ӧ��Ƴ�һ��ԭ��أ���д����ԭ��صĸ�����Ӧ��______________________________________
_______________________________________________________________��
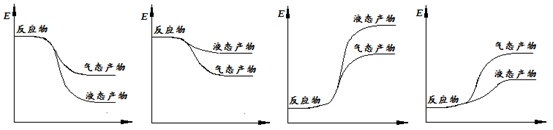
(2)ijʵ��С��ģ�ҵ�ϳɰ���ӦN2(g)��3H2(g) 2NH3(g)����H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol(�����1��1)����5 L�ϳ����У���ӦǰѹǿΪp0����Ӧ������ѹǿ��p��ʾ����Ӧ������
2NH3(g)����H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol(�����1��1)����5 L�ϳ����У���ӦǰѹǿΪp0����Ӧ������ѹǿ��p��ʾ����Ӧ������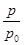 ��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ش��������⣺
�ٷ�Ӧ��ƽ��ı�־��(����ĸ����)________��
A��ѹǿ���ֲ���
B�������ܶȱ��ֲ���
C��NH3������������N2���������ʵ�2��
��0��2 min�ڣ���c(N2)�仯��ʾ��ƽ����Ӧ����Ϊ________��
�������N2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��
A������ϵ�а������1��1�ٳ���N2��H2
B�������NH3
C�������¶�
D�����뺤��ʹѹǿ����
E������һ������N2
(3)25 ��ʱ��BaCO3��BaSO4���ܶȻ������ֱ���8��10��9��1��10��10��ij����BaCO3����������Һ�У�c(CO32��)��0.2 mol��L��1���������������Na2SO4��Һ����Ҫ����BaSO4����������Na2SO4��Һ�����ʵ���Ũ����С��________ mol��L��1��
��.
��.(1)D��CO��2e����CO32��=2CO2
(2)��AC����0.1 mol��L��1��min��1����AB��(3)0.01
����

���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1���ڹ̶��ݻ����ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��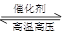 2NH3��g�� ��H=��92��4kJ/mol��
2NH3��g�� ��H=��92��4kJ/mol��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
���ж�K1 K2����д��>�� �� =����<������
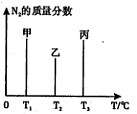
��2����2mol N2��3mol H2�ϳɰ����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䣬������������ͬ������£�ʵ���÷�Ӧ�����е�t minʱN2������������ͼ��ʾ����ʱ�ס��ҡ�������������һ���ﵽ��ѧƽ��״̬���� �����ﵽƽ��״̬ʱ��N2ת������͵��� ��
��3��NH3��CO2��120oC�����������¿��Ժϳɷ�Ӧ�������أ�CO2 +2NH3
 ��NH2��2CO +H2O
��NH2��2CO +H2O���ܱշ�Ӧ�����У����������NH3�ĺ����仯��ϵ��ͼ��ʾ
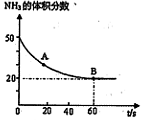
��������������Ϊ���壩����A�������Ӧ/����
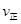 ��CO2�� B����淴Ӧ����
��CO2�� B����淴Ӧ����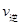 ��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ��
��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ����4����֪�����Ȼ�ѧ����ʽ��
2H2��g��+O2��g��=2H2O��1�� ��H = -571��6kJ/mol
N2��g��+O2��g��
 2NO��g�� ��H =+180kJ/mol
2NO��g�� ��H =+180kJ/mol��д����NH3��ԭNO���Ȼ�ѧ����ʽ_ ��
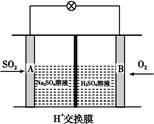
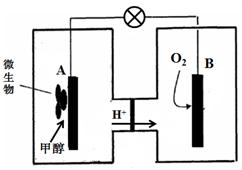
��5�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ____ ����ѧ�����ô�ԭ������Ƴɰ���������ȼ�ϵ�أ���ͨ�˰����ĵ缫�� ��������������������ڼ��������£�ͨ�˰����ĵ缫�����ĵ缫��ӦʽΪ ��
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ���á�
��1�����̼�Ȼ�ԭһ�Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+ 2AlCl3��g��+ 6C��s����6AlCl��g��+ 6CO��g������H�� a kJ?mol-1
3AlCl��g���� 2Al��l��+ AlCl3��g������H�� b kJ?mol-1
��ӦAl2O3��s��+ 3C��s���� 2Al��l��+ 3CO��g���ġ�H�� kJ?mol-1
���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+ 2NO��g��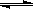 N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1��00 | 0��68 | 0��50 | 0��50 | 0��60 | 0��60 |
| N2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
| CO2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
��0��10min�ڣ�NO��ƽ����Ӧ����v��NO��= ��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������ ������ĸ��ţ�
a��ͨ��һ������NO b������һ�����Ļ���̿
c��������ʵĴ��� d���ʵ���С���������
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1����Q 0���������������
���ں��ݾ��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬�������� ����ѡ���ţ�
a����λʱ��������2nmol NO��g����ͬʱ����nmol CO2��g��
b����Ӧ��ϵ���¶Ȳ��ٷ����ı�
c�����������ܶȲ��ٷ����ı�
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����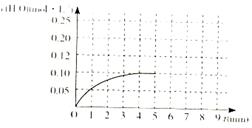
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO(g)��2H2(g)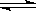 CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g)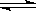 CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
| �¶� | 250 �� | 300 �� | 350 �� |
| K | 2.041 | 0.270 | 0.012 |
�ɱ��������жϣ���H1______0(�����������������)��
��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol��L��1����CO��ת����Ϊ________����ʱ���¶�Ϊ________(���ϱ���ѡ��)��
(2)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)=2CO2(g)��4H2O(g) ��H1����1 275.6 kJ��mol��1
��2CO(g)��O2(g)=2CO2(g) ��H2����566.0 kJ��mol��1
��H2O(g)=H2O(l)����H3����44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��______________________________________��
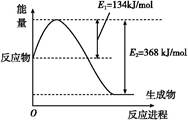
 2NO(g)����H="+179.5" kJ/mol
2NO(g)����H="+179.5" kJ/mol