题目内容
下列有关试验操作的叙述正确的是( )





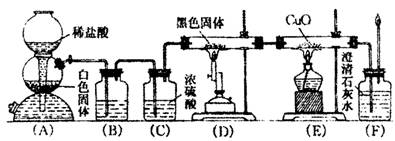
| A.实验室制取少量的乙酸乙酯时,浓硫酸作催化剂和脱水剂 |
| B.将铜丝灼热后伸入到乙醇中,反应后铜丝的质量增重 |
| C.用苯萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出 |
| D.在制取少量的乙酸乙酯时,先在试管中加入浓硫酸,再加入乙醇和乙酸的混合液 |
C
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

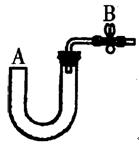
 液流入B中,充分振荡,目的是
液流入B中,充分振荡,目的是  。
。
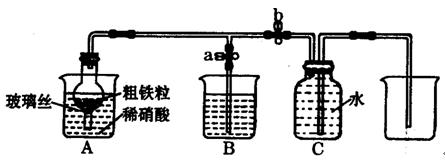
 Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是( )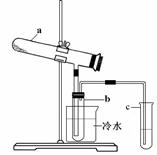
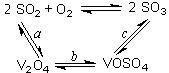
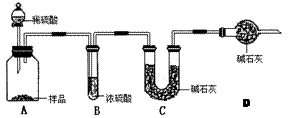
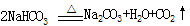 。请回答:
。请回答: 成 功
成 功 成 功
成 功