��Ŀ����
4��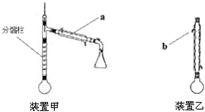 ���������dz��õ�ҽҩ�м��壬���ɱ����������Ʊ�����Ӧ�Ļ�ѧ����ʽ���£�
���������dz��õ�ҽҩ�м��壬���ɱ����������Ʊ�����Ӧ�Ļ�ѧ����ʽ���£�
�йػ�������������ʼ��±���
| ������ | �ܶȣ�g��cm-3�� | �ܽ��� | �۵㣨�棩 | �е㣨�棩 |
| ���� | 1.05 | ������ˮ���Ҵ� | 17 | 118 |
| ���� | 1.02 | ����ˮ���������Ҵ� | -6 | 184 |
| �������� | - | ������ˮ����������ˮ���������Ҵ� | 114 | 304 |
�����ף�����װ�üף�������������������ʯ�ͷ����еķ�����������Բ����ƿ�м���5��0mL ������7.4mL���ᣬ�������У������¶ȼƶ���100��105�棬����Һ��ƽ����������Ӧ40min��ֹͣ���ȣ���Բ����ƿ�е�Һ����ȵ���ʢ��100mLˮ���ձ�����ȴ�������������������������˵ôֲ��
�����ң�����װ���ң����Ȼ�������Ӧ40min��ֹͣ���ȣ������뷽������ͬ��
�ᴿ�������������������ؽᾧ�������������£�
�ټ����ܽ���ڻ���̿��ɫ���۳��ȹ��ˡ�����ȴ�ᾧ���ݹ��ˡ���ϴ�ӡ��߸���
��ش�
��1������a�������������ܣ�b��ˮ�������dz�ˮ�����ˮ����ˮ������
��2���ϳɲ����У��������������������˷�����ֲ��������Һ�е���Ҫ���������ᣮ
��3���ᴿ�����еĵڢ۲�������Ҫ���ȵ������Ƿ�ֹ�¶Ƚ��͵��������������������Ͳ��ʣ�
��4���ᴿ���̵ڢ�ϴ�ӣ�����ϴ�Ӽ�������ʵ���A��
A������ˮ B���Ҵ� C��5%Na2CO3��Һ D������NaCl��Һ
��5����Ͷ����������Ϊ��������������ʣ��������ַ�������ȡ�Ĵ�ʩ�����������ʵ�������������IJ��ʽϸߣ�ԭ���Ƿ�������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��
���� ��1������װ��ͼ��֪�������ƣ�����������ȴЧ�����жϣ�
��2����Բ����ƿ�м���5.0mL ������7.4mL���ᣬ���������ᷴӦ�ǰ�1��1��Ӧ��������������ܶȽӽ�����������������ݴ˴��⣻
��3���ᴿ�����еĵڢ۲�����Ŀ���ǽ�����̿��ȥ����ƷҪ������Һ�У�����Ҫ���ȹ��ˣ���ֹ����������ȴ����������ɲ�Ʒ��ʧ��
��4����������������ˮ����������ˮ���������Ҵ�������ϴ���Ǽ�Ҫ��ȥ���������ʣ���Ҫ��ֹ��Ʒ�ܽ����ɲ�Ʒ��ʧ��Na2CO3��Һ������NaCl��Һϴ���ֻ��������ʣ�
��5���������ַ�������ȡ���������������������������ʣ�����������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��ʹ�üIJ��ʽϸߣ�
��� �⣺��1������װ��ͼ��֪����a�������������ܣ�����������ȴЧ���ÿ�֪b��ˮ�������dz�ˮ��
�ʴ�Ϊ�������ܣ���ˮ��
��2����Բ����ƿ�м���5.0mL ������7.4mL���ᣬ���������ᷴӦ�ǰ�1��1��Ӧ��������������ܶȽӽ����������������������Һ�е���Ҫ���������ᣬ
�ʴ�Ϊ�����
��3���ᴿ�����еĵڢ۲�����Ŀ���ǽ�����̿��ȥ����ƷҪ������Һ�У�����Ҫ���ȹ��ˣ���ֹ����������ȴ����������ɲ�Ʒ��ʧ��
�ʴ�Ϊ����ֹ�¶Ƚ��͵��������������������Ͳ��ʣ�
��4����������������ˮ����������ˮ���������Ҵ�������ϴ���Ǽ�Ҫ��ȥ���������ʣ���Ҫ��ֹ��Ʒ�ܽ����ɲ�Ʒ��ʧ��Na2CO3��Һ������NaCl��Һϴ���ֻ��������ʣ�����������ˮϴ�ӽϺ��ʣ���ѡA��
��5���������ַ�������ȡ���������������������������ʣ�����������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��ʹ�üIJ��ʽϸߣ�
�ʴ�Ϊ�������������������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��
���� ���⿼���л���ĺϳ�ʵ�顢����������ʵ�������Ŀ�����������۵ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�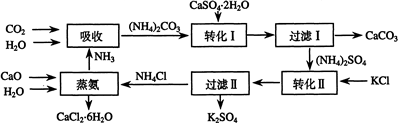
��1�������������õ�ԭ�ϳ�CaSO4•2H2O��KCl�⣬����ҪCaCO3������CaO����NH3��H2O��ԭ��
��2��д��ʯ������Һ�м���̼�����Һ������Ӧ�����ӷ���ʽ��
CaSO4+CO32-=CaCO3+SO42-
��3�����ˢ�������ù����У���CaCO3�����CaSO4���ѧʽ�������ʣ��ù������������ˮ���ԭ�ϣ�
��4�����ˢ����������Һ�ǣ�NH4��2SO4��Һ��������Һ�к���CO32-�ķ����ǣ�ȡ������Һ���μ�ϡ���ᣬ�������ݲ�������CO32-��
��֮����CO32-��
��5����֪��ͬ�¶���K2SO4��100gˮ�дﵽ����ʱ�ܽ���������
| �¶ȣ��棩 | 0 | 20 | 60 |
| K2SO4�ܽ������g�� | 7.4 | 11.1 | 18.2 |
��6���Ȼ��ƽᾧˮ���CaCl2•6H2O����Ŀǰ���õ������Ȳ��ϣ�ѡ���������Ad
A���۵�ϵͣ�29���ۻ��� b���ܵ��� c�������� d����
��7����������������������ɫ��ѧ������ǣ�̼���������ˮ��ԭ�ϡ�����ƺ��Ȼ���ת��Ϊ����غ��Ȼ��ơ����ڹ�����ѭ��ʹ�õ�
ԭ�������ʸߣ�û���к������ŷŵ������У�
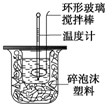 ������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�������Ͳ��ȡ50mL 0.25mol/L���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50mL 0.55mol/L NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȣ�
�ش��������⣺
��1��д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ���к�����ֵΪ57.3kJ/mol����$\frac{1}{2}$H2SO4��aq��+NaOH��aq���T$\frac{1}{2}$Na2SO4��aq��+H2O��l����H=-57.3kJ•mol-1��
��2������NaOH��Һ����ȷ������C��������ѡ������
A���ز������������롡B���������������� C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������D ��������ѡ������
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β���������ؽ���
��4��ʵ���������±���
������д�±��еĿհף�
| �¶� ʵ������� | ��ʼ�� ��t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�� ȡС�����һλ����
������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ������ǣ�����ĸ��abcd��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��5����֪��P4�����ף�s��+5O2��g���TP4O10��s����H=-2983.2kJ/mol
P�����ף�s��+$\frac{5}{4}$O2��g���T$\frac{1}{4}$P4O10��s����H=-738.5kJ/mol
��д������ת��Ϊ�����Ȼ�ѧ����ʽP4�����ף�s��=4P�����ף�s����H=-29.2kJ/mol��
| A�� | Cu2++2OH-=Cu��OH��2�� CuCO3+2NaOH�TCu��OH��2��+Na2CO3 | |
| B�� | CO32-+2H+=CO2��+H2O BaCO3+2HCl�TBaCl2+CO2��+H2O | |
| C�� | Ca2++CO32-=CaCO3�� Ca��NO3��2+Na2CO3�TCaCO3��+2NaNO3 | |
| D�� | H++OH-=H2O 2KOH+H2SO4�TK2SO4+2H2O |
��ʳ��ˮ
��NaOH
������
��Һ̬��
������
��KClO3��
| A�� | ������ڢۢ� | B�� | �����٢ۢ� | C�� | ����ʢڢ� | D�� | �ǵ���ʢܢ� |
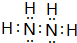
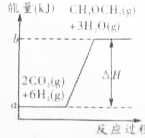 ����ҵ���ƶ���������һ���¶ȣ�230��280�棩��ѹǿ��2.0��10.0MPa���ʹ������ý��еģ���Ӧ���з��������з�Ӧ��
����ҵ���ƶ���������һ���¶ȣ�230��280�棩��ѹǿ��2.0��10.0MPa���ʹ������ý��еģ���Ӧ���з��������з�Ӧ��