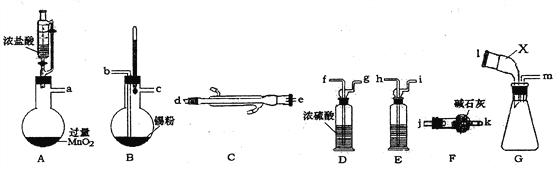
题目内容
【题目】下列方法不属于污水处理方法的是( )
A. 用蒸馏法制备纯净水
B. 用混凝法除去水中悬浮物颗粒
C. 用熟石灰处理电镀厂产生的酸性水
D. 用沉淀法除去水中的重金属离子
【答案】A
【解析】根据污水的组成、结合蒸馏法、混凝法等特点分析解答。
A. 可用蒸馏法制备纯净水,不能用于污水处理,A错误;
B. 混凝法就是向废水中投放混凝药剂,使其中的胶体和细微悬浮物脱稳,进而可以通过重力沉降或其他固液分离手段予以去除的废水处理技术,因此可用混凝法除去水中悬浮物颗粒,B正确;
C. 熟石灰是氢氧化钙,属于强碱,可用熟石灰处理电镀厂产生的酸性水,C正确;
D. 可用沉淀法除去水中的重金属离子,D正确。答案选A。

【题目】下表是几种弱电解质的电离平衡常数 (25℃)。
电解质 | 电离方程式 | 平衡常数K |
CH3COOH | CH3COOH | 1.76 × 10 -5 |
H2CO3 | H2CO3 HCO3— | K1=4.31 × 10 -7 K2=5.61 × 10 -11 |
C6H5OH | C6H5OH | 1.1 × 10 -10 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.52 × 10 -3 K2=6.23× 10 -8 K3=2.20× 10 -13 |
NH3·H2O | NH3·H2O | 1.76× 10 -5 |
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若 ① CH3COOH ② HCO3— ③ C6H5OH ④ H2PO4— 均可看作酸,则它们酸性由强到弱的顺序为___________(填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:__________________________;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO—)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10 mL 0.01 mol/L苯酚溶液中滴加V mL 0.01 mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥ 10
B.若混合液pH<7,则c((NH4+) >c (C6H5O—) >c (H+)>c (OH—)
C.V=10时,混合液中水的电离程度小于10 mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______________。
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D