题目内容
在一个容积为500mL的密闭容器中,充入5molH2和2molCO。在一定温度,一定压强下,发生如下反应:2H2(g)+CO(g)  CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求
(1) 以H2的浓度变化表示的该反应的速率;
(2) 到平衡时CO的转化率;
(3) 平衡混合气的密度与相同状况下的氢气密度之比。
 CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求
CH3OH(g),经过5min后达到平衡状态。若此时测得CH3OH 蒸气的浓度为2mol/L,求(1) 以H2的浓度变化表示的该反应的速率;
(2) 到平衡时CO的转化率;
(3) 平衡混合气的密度与相同状况下的氢气密度之比。
(1)0.8mol/(L.min); (2)50%;(3)6.6
试题分析:5min后达到平衡,CH3OH的物质的量为2 mol/L×0.5L=1mol。“三行式”如下:
2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)开始的物质的量 5mol 2mol 0mol
反应的物质的量 2mol 1mol 1mol
5min后物质的量 3mol 1mol 1mol
(1)v(H2)=△c(H2)÷t=△n(H2)÷V÷t=2mol÷0.5L÷5min=0.8mol/(L.min)。
(2)到平衡时CO的转化率为1mol÷2mol×100%=50%。
(3)根据密度之比等于摩尔质量之比得,平衡混合气的密度与相同状况下的氢气密度之比为M(气)÷M(H2)=m(气)÷n(气)÷2 mol/L =(5mol×2mol/L+2mol×28 mol/L) ÷(3mol+1mol+1mol)÷2 mol/L ="13.2" mol/L÷2 mol/L=6.6。
点评:本题考查的是化学反应速率和限度的相关知识,题目难度不大,考查学生对基础知识的掌握程度及计算的能力。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
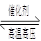 2NH3的反应中,在5s中NH3的浓度变化了8mol/L。则NH3的平均反应速率( )
2NH3的反应中,在5s中NH3的浓度变化了8mol/L。则NH3的平均反应速率( )
 2SO3(g)
2SO3(g) 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是  2AB(g)的△H<0,下列说法正确的是
2AB(g)的△H<0,下列说法正确的是