题目内容
五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是 ( )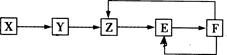
| A.M元素可能是非金属元素,也可能是金属元素 |
| B.X可能是一种氢化物 |
| C.E可能是一种有色气体 |
| D.X→Y可能是非氧化还原反应 |
A
解析试题分析: 解:Y是单质,Z是NO,五种常见物质X、Y、Z、E、F均含有同一元素M,则Y为N2,X为NH3,E为NO2,F为HNO3,由元素守恒可知,M一定为N元素,不会是金属,故A误;。X为氨气,是一种氢化物,故B确; .E为NO2,为红棕色气体,故C正确; .X→Y中,N元素的化合价升高,被氧化,一定为氧化还原反应,故D错误;
考点:

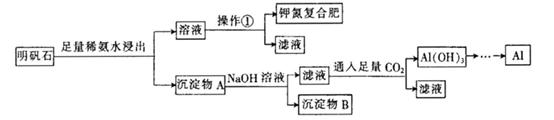
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: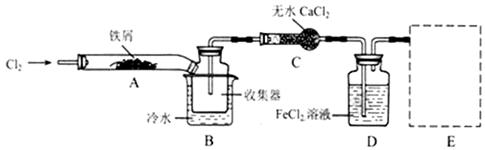
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(3)如果没有装置C的设计,会导致
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | _________________。 | 说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明:________________________。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A.青石棉是一种硅酸盐产品 |
| B.青石棉中含有一定量的石英晶体 |
| C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| D.1 mol青石棉能使1 mol HNO3被还原 |
除去氯气中混有的少量的氯化氢气体,最好选用
| A.水 | B.饱和食盐水 |
| C.纯碱溶液 | D.饱和烧碱溶液 |
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2,下列说法中错误的是 ( )
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
下列关于硅单质及其化合物的说法正确的是 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维  ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
| A.①② | B.②③ | C.①④ | D.③④ |
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是( )
| A.NaOH | B.NH3·H2O | C.AgNO3 | D.BaCl2 |