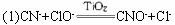题目内容
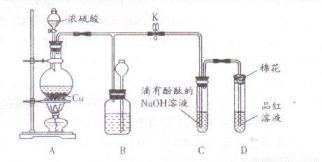
用下图所示装置(装置内先充有空气)进行铜与稀硝酸反应的实验,请填写下列空格。
(1)实验开始时,先将烧瓶加热,其目的是_______________________________________。
(2)在不断摇动烧瓶的条件下,使反应充分进行。可观察到4个主要现象:
①铜丝逐渐减小,但不完全消失,且表面有气泡生成;
②气球先略变大,在摇动情况下又变小,而后变大;
③_____________________________________________________________;
④_____________________________________________________________。
(3)在摇动情况下,导致气球变小的有关反应的化学方程式为:______________________。
(1)提高反应速率
(2)③无色溶液变蓝 ④烧瓶中气体呈红棕色,最终为无色
(3)2NO+O2====2NO2
3NO2+H2O====2HNO3+NO(或4NO+3O2+2H2O====4HNO3或4NO2+O2+2H2O====4HNO3)
解析:Cu与稀HNO3反应生成NO,要注意反应现象的描述,NO遇O2生成NO2,NO2可与水蒸气反应,可使气体体积减小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目