题目内容
(16分)以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
①该反应在常温下 自发进行(填“能”与“不能”);
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有
Ⅰ混合气体的密度; Ⅱ容器内气体的压强;
Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ D.Ⅰ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气。反应为H2O(g)+CO(g) H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应

①下列措施中能使c (CH3OH)增大的是 。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2和3mol H2
②在温度T1时,当反应达到平衡时,测得n(H2) =" 2.4" mol;其它条件不变,在温度T2时,当反应达到平衡时,测得n(CO2) =" 0.82" mol,则T2 T1。(填“>”、“<”或“=”),
(4)在一定条件下科学家从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol。
①写出工业上以CO2、H2合成CH3OH和液态水的热化学方程式: ;
②该转化的积极意义是 ;
③有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,①该反应在常温下 自发进行(填“能”与“不能”);
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有
Ⅰ混合气体的密度; Ⅱ容器内气体的压强;
Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ D.Ⅰ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气。反应为H2O(g)+CO(g)
 H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。
H2(g)+CO2(g),某温度下该反应的平衡常数K= 4/9。该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示。下列判断不正确的是 。| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
CH3OH(g)+H2O(g) ,右图表示该反应进行过程中能量(单位为kJ?mol—1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2反应
①下列措施中能使c (CH3OH)增大的是 。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2和3mol H2
②在温度T1时,当反应达到平衡时,测得n(H2) =" 2.4" mol;其它条件不变,在温度T2时,当反应达到平衡时,测得n(CO2) =" 0.82" mol,则T2 T1。(填“>”、“<”或“=”),
(4)在一定条件下科学家从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol。
①写出工业上以CO2、H2合成CH3OH和液态水的热化学方程式: ;
②该转化的积极意义是 ;
③有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:
(1) ①不能 ② D (2)C (3) ① CD ② >
(4)①CO2(g)+3H2(g)→CH3OH(l)+H2O(l) △H=-131.9kJ/mol
②可降低温室效应和弥补资源短缺
③不可行,该反应是一个焓增、熵减的反应,所以不能自发进行
(4)①CO2(g)+3H2(g)→CH3OH(l)+H2O(l) △H=-131.9kJ/mol
②可降低温室效应和弥补资源短缺
③不可行,该反应是一个焓增、熵减的反应,所以不能自发进行
(1)反应是体积增大的,吸热放热可逆反应,所以在常温下不能自发进行。因为恒温,在容积可变的密闭容器中进行,所以I、Ⅱ、Ⅲ均不能说明。只有当CO物质的量浓度不再变化时可以说明。
(2)反应开始时丙中浓度最大,甲中浓度最小,反应速率丙最快,甲最慢。因为反应前后体积不变,而甲和丙中反应物的浓度之比相同,所以其平衡是等效的,所以C不正确。根据方程式可知 H2(g)+CO2(g) H2O(g)+CO(g)
H2O(g)+CO(g)
起始量(mol) 0.010 0.010 0 0
转化量(mol) x x x x
平衡量(mol) 0.010-x 0.010-x x x
所以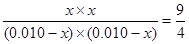 ,解得x=0.006,即转化率是60%。乙中最大氢气的浓度,可以提高二氧化碳的转化率。
,解得x=0.006,即转化率是60%。乙中最大氢气的浓度,可以提高二氧化碳的转化率。
(3)根据图像可知该反应是放热反应,升高温度平衡向逆反应方向移动。充入He(g),使体系压强增大,则原体系的物质的浓度将减小,平衡向逆反应方向移动。降低生成物水的浓度,平衡向正反应方向移动,c (CH3OH)增大。若再充入1mol CO2和3mol H2,相当于增大体系的压强,平衡向正反应方向移动,c (CH3OH)增大。在温度T2时,当反应达到平衡时,测得n(CO2) =" 0.82" mol,则此时n(H2) ="2.46" mol.因为反应放热,温度越高氢气的物质的量越多,所以T2大于T1。
(4)根据盖斯定律和燃烧热的热化学方程式可以得到CO2、H2合成CH3OH和液态水的热化学方程式。在反应中消耗二氧化碳,所以可以降低温室效应,同时生成甲醇可以弥补资源短缺。因为△H>0、△S<0,所以该反应不能自发进行。
(2)反应开始时丙中浓度最大,甲中浓度最小,反应速率丙最快,甲最慢。因为反应前后体积不变,而甲和丙中反应物的浓度之比相同,所以其平衡是等效的,所以C不正确。根据方程式可知 H2(g)+CO2(g)
 H2O(g)+CO(g)
H2O(g)+CO(g)起始量(mol) 0.010 0.010 0 0
转化量(mol) x x x x
平衡量(mol) 0.010-x 0.010-x x x
所以
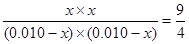 ,解得x=0.006,即转化率是60%。乙中最大氢气的浓度,可以提高二氧化碳的转化率。
,解得x=0.006,即转化率是60%。乙中最大氢气的浓度,可以提高二氧化碳的转化率。(3)根据图像可知该反应是放热反应,升高温度平衡向逆反应方向移动。充入He(g),使体系压强增大,则原体系的物质的浓度将减小,平衡向逆反应方向移动。降低生成物水的浓度,平衡向正反应方向移动,c (CH3OH)增大。若再充入1mol CO2和3mol H2,相当于增大体系的压强,平衡向正反应方向移动,c (CH3OH)增大。在温度T2时,当反应达到平衡时,测得n(CO2) =" 0.82" mol,则此时n(H2) ="2.46" mol.因为反应放热,温度越高氢气的物质的量越多,所以T2大于T1。
(4)根据盖斯定律和燃烧热的热化学方程式可以得到CO2、H2合成CH3OH和液态水的热化学方程式。在反应中消耗二氧化碳,所以可以降低温室效应,同时生成甲醇可以弥补资源短缺。因为△H>0、△S<0,所以该反应不能自发进行。

练习册系列答案
相关题目
 2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol  O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1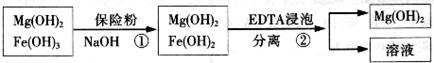
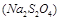 的作用: 。
的作用: 。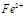 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与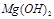 反应。虽然
反应。虽然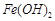 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将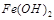 除去并获得纯度高的
除去并获得纯度高的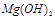 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ; 0分)汽车尾气中含有CO、NO2
0分)汽车尾气中含有CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。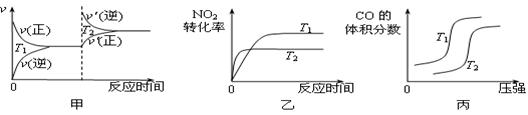 ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲
ΔH= ▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲  (填代号)。
(填代号)。