题目内容
下列说法中正确的是( )
①CO2与CS2互为等电子体;
②同一周期从左到右,元素的电负性、原子的半径都是越来越大;
③价电子数等于族序数;
④含有阳离子的晶体一定是离子晶体;
⑤温度越高,金属的导电性越好;
⑥熔融状态下能导电的化合物一定是离子晶体;
⑦P4和CH4都是正四面体分子且键角都为109°28ˊ.
①CO2与CS2互为等电子体;
②同一周期从左到右,元素的电负性、原子的半径都是越来越大;
③价电子数等于族序数;
④含有阳离子的晶体一定是离子晶体;
⑤温度越高,金属的导电性越好;
⑥熔融状态下能导电的化合物一定是离子晶体;
⑦P4和CH4都是正四面体分子且键角都为109°28ˊ.
| A、①②③ | B、⑤⑥⑦ | C、①④⑥⑦ | D、①⑥ |
分析:等电子体指 原子个数相等价电子数目相等价电子数目相等的微粒;
同周期从左到右,元素的非金属性依次增强,电负性依次增强,原子半径依次减小;
主族元数的价电子数等于最外层电子数=主族序数;而过渡元素的价电子,包括最外层电子,还有部分次外层电子,镧系,锕系的还包括倒数第三层的部分电子;
离子晶体是有阳离子和阴离子构成,金属晶体是由自由电子和阳离子构成;
金属导电是金属中自由电子做定向移动导电的,取决于单位体积内自由电子数和金属导体中原子热运动的剧烈程度即温度,单位体积内自由电子数越多,温度越低,金属的导电性能越好;
白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心,C-H键键角为白磷键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°.
同周期从左到右,元素的非金属性依次增强,电负性依次增强,原子半径依次减小;
主族元数的价电子数等于最外层电子数=主族序数;而过渡元素的价电子,包括最外层电子,还有部分次外层电子,镧系,锕系的还包括倒数第三层的部分电子;
离子晶体是有阳离子和阴离子构成,金属晶体是由自由电子和阳离子构成;
金属导电是金属中自由电子做定向移动导电的,取决于单位体积内自由电子数和金属导体中原子热运动的剧烈程度即温度,单位体积内自由电子数越多,温度越低,金属的导电性能越好;
白磷和甲烷虽然都是正四面体结构,但是甲烷中四个H原子位于四个顶点,C原子位于四面体的中心,C-H键键角为白磷键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°.
解答:解:A.②同周期从左到右,元素的非金属性依次增强,电负性依次增强,原子半径依次减小.③主族元数的价电子数等于最外层电子数=主族序数;而过渡元素的价电子,包括最外层电子,还有部分次外层电子,镧系,锕系的还包括倒数第三层的部分电子,A错误;
B.⑤金属导电是金属中自由电子做定向移动导电的,取决于单位体积内自由电子数和金属导体中原子热运动的剧烈程度即温度,单位体积内自由电子数越多,温度越低,金属的导电性能越好;⑦白磷键角是60°甲烷键角是109°28ˊ,二者键角不同,B错误;
C.④含有阳离子的晶体不一定是离子晶体也可能是金属晶体,C错误;
D.①CO2与CS2二者原子个数相等且价电子数目相等,所以二者是等电子体;⑥熔融状态下能导电的化合物一定是离子晶体,D正确;
故:选D.
B.⑤金属导电是金属中自由电子做定向移动导电的,取决于单位体积内自由电子数和金属导体中原子热运动的剧烈程度即温度,单位体积内自由电子数越多,温度越低,金属的导电性能越好;⑦白磷键角是60°甲烷键角是109°28ˊ,二者键角不同,B错误;
C.④含有阳离子的晶体不一定是离子晶体也可能是金属晶体,C错误;
D.①CO2与CS2二者原子个数相等且价电子数目相等,所以二者是等电子体;⑥熔融状态下能导电的化合物一定是离子晶体,D正确;
故:选D.
点评:本题考查了等电子体的概念、元素性质递变规律、晶体的构成、金属晶体导电的原因、白磷甲烷空间构型,题目涉及到的知识点多,难度较大.易错点:等电子体概念的理解;白磷和甲烷结构的理解;什么是价电子.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
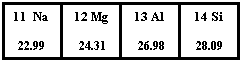 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是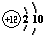 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |