题目内容
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=_________kJ·mol-1
(2)工业上极少用方法I制取Cu2O是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:________________。
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:写出电极反应式并说明该装置制备Cu2O的原理___________________。

(5)在相同的密闭容器中.用以上两种方法制得的Cu2O分别进行催化分解水的实验:
![]() △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1·min-1
C.实验②比实验①所用的Cu2O催化效率高
D.实脸①、②、③的化学平衡常数的关系:K1=K2<K3
【答案】23.(1)2c-a-b;(2)若温度不当,会生成Cu;
(3)4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;
(4)阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O;(5)CD
【解析】
试题分析:(1)根据盖斯定律,2Cu(s)+1/2O2(g)=Cu2O(s)△H=akJ·mol-1①,C(s)+1/2O2(g)=CO(g)△H=bkJ·mol-1②,Cu(s)+1/2O2(g)=CuO(s)△H=ckJ·mol-1③,根据盖斯定律2×③-①-②可得方法Ⅰ发生的反应为2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ·mol-1。
(2)方法Ⅰ是用碳粉还原氧化铜,若温度不当,会生成Cu,降低Cu2O产率。
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,根据得失电子守恒和原子守恒配平,反应的化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O。
2Cu2O+N2↑+6H2O。
(4)根据电解装置图,Ti电极是阴极,溶液中的H+在阴极得电子生成氢气,则阴极电极反应为2H++2e-=H2↑,阴极c(OH-)增大,通过阴离子交换膜进入阳极室,阳极是活泼电极铜,该电极本身发生失电子的氧化反应,在碱性环境下生成Cu2O,即阳极电极反应为2Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O;
(5)A.实验温度越高达到化学平衡时用的时间越短,②达到平衡用30min,而①则用了40min,所以T2>T1,A项错误;B.实验①前20min的平均反应速率v(O2)=[(0.050-0.0486)/2]÷20min=3.5×10-5molL-1min-1,B项错误;C.实验①和②化学平衡状态未改变,说明加入了催化剂,而实验②到达平衡所需的时间短,说明实验②比实验①所用的Cu2O催化效率高,C项正确;D.实验①和②化学平衡状态未改变,说明加入了催化剂,催化剂不影响化学平衡常数,则K1=K2;根据表格信息,实验③耗时更短,平衡时水蒸气的含量减少,说明平衡正向移动,平衡常数增大,即K1=K2<K3,D项正确;答案选CD。

【题目】碳元素是构成细胞的最基本元素,对此最有说服力的解释是 ( )
A. 碳在细胞的各种化合物中含量最多
B. 碳在自然界中含量最为丰富
C. 在细胞的各种化合物中都含有碳
D. 碳链构成了有机物的基本骨架
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强酸溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
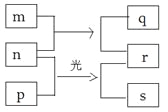
X | Y | |
Z | W |
A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸