题目内容
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
B
本题看似复杂,但根据向反应后的溶液中加入NaOH溶液后的溶质只有NaNO3,就可快速解答。根据钠元素和氮元素的对应关系可以求出NaOH的物质的量,n(NaOH)=0.25×1.8-1.12/22.4=0.4 mol。

练习册系列答案
相关题目

 Cr2O72-+ H2O
Cr2O72-+ H2O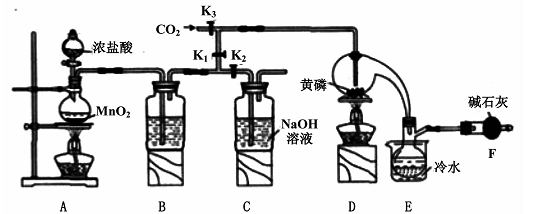

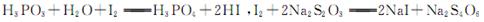 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。