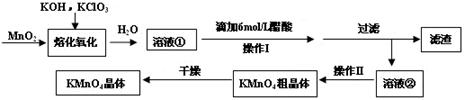
题目内容
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A.M | B.M2+ | C.M3+ | D.MO2+ |
B
试题分析:n(Zn)= 0.195g ÷65g/mol=0.003mol,Zn是+2价的金属,假设反应后M的化合价为+x价,根据氧化还原反应中电子转移数目相等可知:0.003×2=0.1×0.02(5-x),解得x=+2价,对选项中含M的微粒的化合价进行分析可知:还原产物是M2+,所以选项是B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
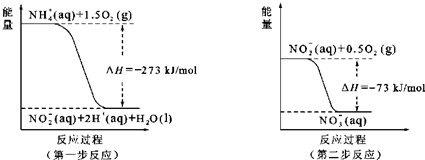
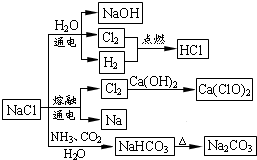
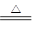 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是