题目内容
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
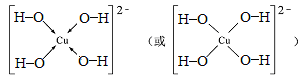
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
(1)1s22s22p63s23p63d3(或[Ar]3d3)(2分)
(2)平面三角形(2分)
(3)N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。(3分)
(4)C≡O (2分)
(5)2×6.02×1023个(或2NA)(2分)
(6)sp3(2分)
 (2分)
(2分)
(2)平面三角形(2分)
(3)N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。(3分)
(4)C≡O (2分)
(5)2×6.02×1023个(或2NA)(2分)
(6)sp3(2分)
 (2分)
(2分)试题分析:(1)W的一种核素在考古时常用来鉴定一些文物的年代,W是C元素,M的氧化物是导致酸雨的主要物质之一,M是N元素,X的某一种单质是大气污染物监测物之一,则X是O元素;Y的基态原子核外有6个原子轨道处于半充满状态,则Y的价电子排布为3d54s1,所以Y是Cr,Z能形成红色的Z2O和黑色的ZO两种氧化物,Z是Cu。所以Y3+基态的电子排布式可表示为1s22s22p63s23p63d3
(2)NO3-离子中,N的价层电子对数为3+1/2(5+1-3×2)=3,所以MX3-的空间构型为平面正三角形;
(3)从化合价角度分析:N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。
(4)CO与氮气是等电子体,化学结构相似,所以CO的结构式类似于氮气,存在三键结构;
(5)CO2分子中存在2个碳氧双键,每个双键都有1个σ键,所以1molCO2分子中存在2NAσ键;
(6)H2O分子中,O的价层电子对数是2+1/2(6-2)=4,所以是sp3杂化;
(7)向Cu2+加入过量NaOH溶液,可生成四羟基合铜络离子,结构式为

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
