题目内容
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:

则x=______________________。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是____________________。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时速率v(HCOOCH3)=__________。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) =__________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正)_____v(逆)(填“﹥”“﹤”“﹦”),原因是_________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1______T3(填“﹥”“﹤”“﹦”),判断的理由是________________。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
2NO+2CO![]() N2+ 2CO2(有CO) 2NO
N2+ 2CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____________________。
②在n(NO)/n(CO)=1的条件下,应控制的最佳温度在___左右.
A.670K B.770K C.870K D.970K.
【答案】 1076 Ⅱ中使用催化剂 0.10 mol·L-1·min-1 2 L·mol-1 ﹤ 浓度商Qc=1.5/(0.5×1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆) ﹥ 此反应为放热反应,降温,平衡向正向进行(或反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高) 此反应为放热反应,升高温度反应更有利于向逆反应方向进行 C(或850~900之间都可以)
【解析】(1)ΔH=反应物的键能总和 - 生成物的键能总和,则ΔH=x+2![]() 436 kJ·mol-1-3
436 kJ·mol-1-3![]() 413 kJ·mol-1-343 kJ·mol-1-465 kJ·mol-1=-99kJ·mol-1,则x=1076。
413 kJ·mol-1-343 kJ·mol-1-465 kJ·mol-1=-99kJ·mol-1,则x=1076。
(2)①由CH3OH(g) +CO(g) ![]() HCOOCH3(g)可知,该反应前后气体的分子数不同。由图像可知,Ⅱ和Ⅰ相比,其平衡状态的压强相同,说明这两个平衡是在相同温度下建立的,但建立平衡所用的时间不同,说明反应速率不同,所以改变的反应条件是:Ⅱ中使用催化剂。
HCOOCH3(g)可知,该反应前后气体的分子数不同。由图像可知,Ⅱ和Ⅰ相比,其平衡状态的压强相同,说明这两个平衡是在相同温度下建立的,但建立平衡所用的时间不同,说明反应速率不同,所以改变的反应条件是:Ⅱ中使用催化剂。
②向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,反应Ⅰ在5min时达到平衡,在此条件下CH3OH(g) +CO(g) ![]() HCOOCH3(g)从反应开始到达到平衡时,由图可知,反应前后的压强之比为4:3。在同温同体积条件下,气体的压强之比等于其物质的量之比,所以平衡时混合气体的总物质的量为3mol,气体的总变化量为1mol,由反应的化学方程式可知,HCOOCH3的平衡量等于气体的总变化量,即n(HCOOCH3)= 1 mol。因此,速率v(HCOOCH3)=
HCOOCH3(g)从反应开始到达到平衡时,由图可知,反应前后的压强之比为4:3。在同温同体积条件下,气体的压强之比等于其物质的量之比,所以平衡时混合气体的总物质的量为3mol,气体的总变化量为1mol,由反应的化学方程式可知,HCOOCH3的平衡量等于气体的总变化量,即n(HCOOCH3)= 1 mol。因此,速率v(HCOOCH3)= ![]() = 0.10 mol·L-1·min-1。
= 0.10 mol·L-1·min-1。
③化学平衡常数只与温度有关,可以由平衡I的数据计算K(II),平衡I体系中各组分的平衡浓度均为0.5mol/L。在相同温度下,反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = K(I)= ![]() 2 L·mol-1。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) ﹤v(逆),原因是:由浓度商Qc=1.5/(0.5
2 L·mol-1。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) ﹤v(逆),原因是:由浓度商Qc=1.5/(0.5![]() 1)=3﹥2=K 可知,反应向逆方向进行,故v(正) ﹤v(逆)。
1)=3﹥2=K 可知,反应向逆方向进行,故v(正) ﹤v(逆)。
④反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)相比,T1﹥T3,判断的理由是:此反应为放热反应,降温可以使平衡向正反应方向移动,容器内气体的压强减小(或反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高)。
(3)①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为:此反应为放热反应,升高温度反应更有利于向逆反应方向进行。
②在n(NO)/n(CO)=1的条件下,由图可知,在870K左右,NO转化为N2的转化率达到最高,故应控制的最佳温度在870K左右,选C(或850~900之间都可以).

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
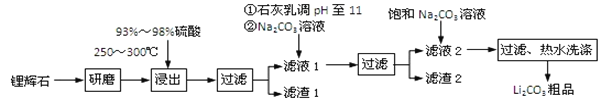
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。

