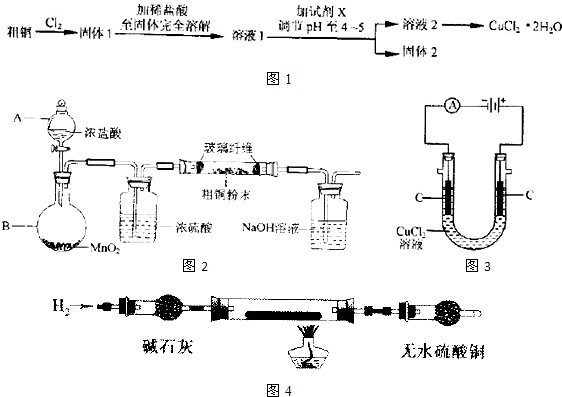
题目内容
在下列实验中Cu能溶解,同时有气体逸出的是( )
分析:A、金属铜、碳棒和盐酸构成的电池中,金属铜发生吸氧腐蚀;
B、原电池中,活泼金属锌为负极,正极金属不发生反应;
C、在电解池中,阴极金属被保护;
D、在电解池中,阳极是活泼金属电极时,则电极本身发生失电子的反应.
B、原电池中,活泼金属锌为负极,正极金属不发生反应;
C、在电解池中,阴极金属被保护;
D、在电解池中,阳极是活泼金属电极时,则电极本身发生失电子的反应.
解答:解:A、金属铜、碳棒和盐酸构成的电池中,金属铜做负极,发生吸氧腐蚀,Cu能溶解,但是没有气体逸出,故A错误;
B、Cu-Zn合金投入到稀硫酸溶液构成的原电池中,活泼金属锌为负极,正极金属Cu不发生反应,Cu不能溶解,故B错误;
C、Zn片、Cu片分别与直流电源正、负极相连后插入氯化钠溶液中,阴极金属Cu被保护,不能溶解,故C错误;
D、将Cu片、Zn片分别与直流电源正、负极相连后插入硫酸钠溶液中,阳极Cu是活泼金属电极,则Cu电极本身发生失电子的反应,Cu能溶解,同时在阴极上有气体氢气逸出,故D正确.
故选D.
B、Cu-Zn合金投入到稀硫酸溶液构成的原电池中,活泼金属锌为负极,正极金属Cu不发生反应,Cu不能溶解,故B错误;
C、Zn片、Cu片分别与直流电源正、负极相连后插入氯化钠溶液中,阴极金属Cu被保护,不能溶解,故C错误;
D、将Cu片、Zn片分别与直流电源正、负极相连后插入硫酸钠溶液中,阳极Cu是活泼金属电极,则Cu电极本身发生失电子的反应,Cu能溶解,同时在阴极上有气体氢气逸出,故D正确.
故选D.
点评:本题考查学生原电池和电解池的工作原理,可以根据教材知识来回答,难度中等.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
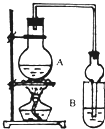 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO3,再加入AgNO3溶液检验Br-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH.
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)A中浓硫酸的作用是
(2)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学反应方程式
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
(4)反应结束后D中的现象是
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.