题目内容
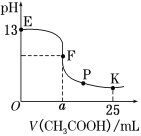
【题目】某温度时,在一个容积为2L 的密闭容器中,X、Y、Z物质的物质的量随时间的变化曲线如图。所示根据图中数据,试填写下列空白:

(1)该反应的化学方程式为______;
(2)反应开始至2min,气体Z的平均反应速率为______;
(3)若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是________;
(4)以下说法能列定该反应已达平衡状态的是________
A.X、Y、Z的浓度之比是1:2:3
B.X的消耗速率和Y的生成速率相等
C.Z的浓度保持不变
D.单位时间内生成0.03molZ的同时生成0.02mol的Y
【答案】 3X+2Y3Z 0.125mol/(L.min) 4:3 BCD
【解析】(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且反应物没有完全转化,是可逆反应;则△n(X):△n(Y):△n(Z)=0.75mol∶0.5mol∶0.75mol=3∶2∶3,则反应的化学方程式为:3X+2Y ![]() 2Z;
2Z;
(2)反应开始至2min,气体Z的平均反应速率为 =0.125mol/(L·min);
=0.125mol/(L·min);
(3)根据阿伏加德罗定律可知,恒容恒温条件下,压强与气体的物质的量成正比,若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是2mol∶(0.25+0.5+0.75)mol=4:3;
(4)A.X、Y、Z的浓度之比是1:2:3时,反应不一定是平衡状态,故A错误;B.X的消耗速率和Y的生成速率相等,即正逆反应速率相等,是平衡状态,故B正确;C.Z的浓度保持不变,量一定是平衡状态,故C正确;D.单位时间内生成0.03molZ的同时生成0.02mol的Y,正逆反应速率相等,是平衡状态,故D正确;答案为BCD。

 新思维寒假作业系列答案
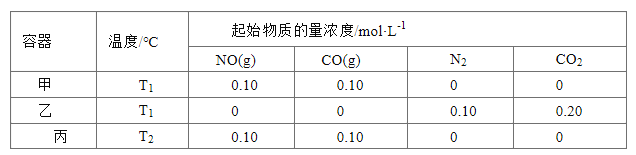
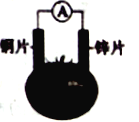
新思维寒假作业系列答案【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
A. ③ B. ① C. ①②③ D. ②③