��Ŀ����
200��ʱ��11.6 g CO2��ˮ�����Ļ�������������Na2O2��ַ�Ӧ��������������3.6 g���ٽ���Ӧ��ʣ�������ȴ����뺬�� ��
�� ��
�� ��
�� �����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����
(����)
�����ӵ�ˮ��Һ�У�����Һ������ֲ��䣬������˵������ȷ����
(����)
A��ԭ��������ƽ��Ħ������Ϊ23.2 g/mol
B�����������Na2O2��Ӧ�����е���ת�Ƶ����ʵ���Ϊ0.25 mol
C����Һ�� �����ʵ���Ũ�Ȼ������ֲ���
�����ʵ���Ũ�Ȼ������ֲ���
D����Һ�� �����ʵ���Ũ�ȼ�С��
�����ʵ���Ũ�ȼ�С�� �����ʵ���Ũ��������
�����ʵ���Ũ�������� ��
�� �����ʵ���Ũ��֮�ͻ������ֲ���
�����ʵ���Ũ��֮�ͻ������ֲ���
A
��������
���������A���������CO2��H2O�����ʵ����ֱ�Ϊm��n
��44m+18n=11.6��
1mol��CO2��1mol��H2O��Na2O2��Ӧ�����������ֱ����ӣ�44-16��=28g����18-16��=2g
����28m+2n=3.6��
�ϲ��٢�
���m=0.1mol n=0.4mol
M(ƽ��)=m(��)/n(��)=11.6g/(0.1mol+0.4mol)= 23.2 g/mol��A��ȷ��
B�2CO2 + 2Na2O2 = 2Na2CO3 + O2�٣�2Na2O2+2H2O="==4NaOH+" O2���ڣ�����ת�Ƶ���0.1mol������ת�Ƶ���0.4mol����ת�Ƶ�����Ϊ0.5mol��B����
C��D�ʣ�������뵽��Һ�У�OH-��HCO3-������Ӧ��OH-+ HCO3-=CO32-+H2O�ۣ���Һ��HCO3-Ũ�ȼ��٣�CO32-Ũ��������Դ2�����棬ʣ�����Na2CO3�еĺͷ�Ӧ�۵ģ� ��
��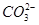 �����ʵ���Ũ��֮�ͻ�����
�����ʵ���Ũ��֮�ͻ�����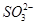 ˮ�ⷽ��ʽΪ��
ˮ�ⷽ��ʽΪ��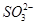 +H20
+H20 HSO32-+OH-�ܣ�ʣ�����NaOH���뵽��Һ�л��д�����OH-����Ӧ�ܻ������ƶ���
HSO32-+OH-�ܣ�ʣ�����NaOH���뵽��Һ�л��д�����OH-����Ӧ�ܻ������ƶ���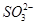 Ũ�Ȼ�����C��D����ѡA��
Ũ�Ȼ�����C��D����ѡA��
���㣺��ѧ����
��������������ݲ��൫�������������Ƶ����ʣ�ˮ�ⷴӦ�����ƶ����dz�����֪ʶ�㡣

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�