题目内容
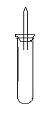
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:请回答下列问题:
(1)在点燃H2之前必须先进行
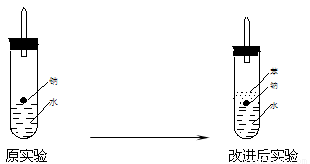
(2)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了.
他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少.于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是
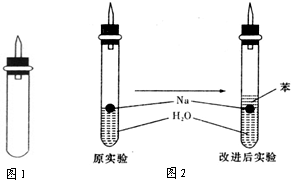
(3)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进.
在改进后的实验中H2的生成速率
(4)2.3g钠投入20mL水中完全反应所得溶液的物质的量浓度是
分析:(1)可燃性气体与空气混合可能发生爆炸;
(2)大块的钠与水反应剧烈,放出大量的热;
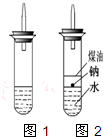
(3)钠的密度比煤油大,比水小;
(5)钠与水发生反应2Na+2H2O=2NaOH+H2↑,根据n=
计算金属Na的物质的量,由方程式计算n(NaOH),再根据c=
计算形成的氢氧化钠溶液的浓度.
(2)大块的钠与水反应剧烈,放出大量的热;
(3)钠的密度比煤油大,比水小;
(5)钠与水发生反应2Na+2H2O=2NaOH+H2↑,根据n=
| m |
| M |
| n |
| V |
解答:解:(1)可燃性气体与空气混合可能发生爆炸,点燃前需要先验纯,故答案为:验纯;
(2)大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸,
故答案为:大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸;
(3)钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,脱离水面,反应停止;
当钠表面的H2逸出,钠又回落水层,如此反复,减小了Na与H2O的反应速率,
故答案为:减慢;
(4)2.3g金属钠的物质的量为
=0.1mol,
令生成的氢氧化钠的物质的量为y,则:
2Na+2H2O=2NaOH+H2↑
2 2
0.1mol y
所以2:2=0.1mol:y,解得y=0.1mol
故所得氢氧化钠溶液的物质的量浓度为
=5mol/L,
故答案为:5mol/L.
(2)大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸,
故答案为:大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸;
(3)钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,脱离水面,反应停止;
当钠表面的H2逸出,钠又回落水层,如此反复,减小了Na与H2O的反应速率,
故答案为:减慢;
(4)2.3g金属钠的物质的量为
| 2,3g |
| 23g/mol |
令生成的氢氧化钠的物质的量为y,则:
2Na+2H2O=2NaOH+H2↑
2 2
0.1mol y
所以2:2=0.1mol:y,解得y=0.1mol
故所得氢氧化钠溶液的物质的量浓度为
| 0.1mol |
| 0.02L |
故答案为:5mol/L.
点评:本题考查常见气体制备原理及装置选择,及物质的量浓度计算,题目难度不大,注意钠与水反应时,取用的钠块不能太大.注意(3)要考虑题给密度的关系,确定钠在反应体系中的位置关系.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
 某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应:
某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应: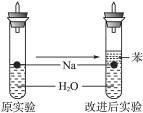
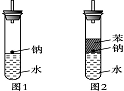 (3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。
(3)实验小组在点燃用图1装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是________________________________________________________________________。