题目内容
有一平均相对分子质量为30的CO、C2H4和O2组成的混合气体,经点燃充分燃烧后,测得反应后的混合气体中不再含有CO和C2H4。完成下列问题。
(1)原混合气体中O2所占的体积分数[φ(O2)]为__________________。
(2)原混合气体中CO的体积分数[φ(CO)]的取值范围为__________________。
(3)原混合气体中C2H4的体积分数[φ(C2H4)]的取值范围为__________________。
(1)50% (2)40%≤φ(CO)<50%
(3)0<φ(C2H4)≤10%
解析:
(1)由于CO和C2H4的相对分子质量均为28,O2的相对分子质量为32,平均相对分子质量是30,根据十字交叉法: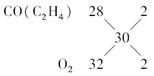 =
=![]()
即O2的体积分数φ(O2)=![]() ×100%=50%。
×100%=50%。
(2)(3)据题意点燃充分燃烧后,不再含有CO和C2H4,说明CO和C2H4完全燃烧,生成CO2和H2O,由C2H4—3O2 2CO—O2,设C2H4 x mol,CO y mol,则消耗n(O2)=(3x+![]() ) mol,而根据(1)可知,n总(O2)=n(C2H4)+n(CO)=(x+y) mol,故有3x+
) mol,而根据(1)可知,n总(O2)=n(C2H4)+n(CO)=(x+y) mol,故有3x+![]() ≤x+y,解得
≤x+y,解得![]() =
=![]() 。
。
即w(C2H4)≤![]() ×50%≤10% 50%-10%≤φ(CO)<50%
×50%≤10% 50%-10%≤φ(CO)<50%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目