题目内容
【题目】(1)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:![]()
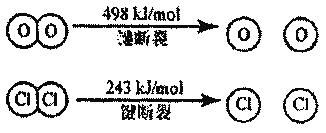
已知:i. 反应A中,4mol HCl被氧化,放出115.6kJ的热量。
ii.
![]()
①HCl的电子式是__________。
②反应A的热化学方程式是____________。
③断开1mol H-O键与断开1mol H-Cl键所需能量相差约______kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)_____。
(2)下图是容积均为1L,分别按4种投料比[n(HCl):n(O2)]分别为1:1、2:1、4:1、6:1进行投料,反应温度对HCl平衡转化率影响的曲线。
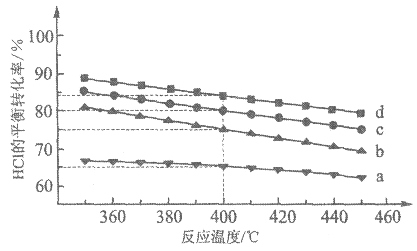
①曲线c对应的投料比是__________。
②用平衡移动的原理解释温度和HCl平衡转化率的关系__________。
③投料比为4:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_____,O2的平衡转化率______。
【答案】![]()
![]() ΔH=-115.6 kJ/mol 32 强 2:l
ΔH=-115.6 kJ/mol 32 强 2:l ![]() ΔH=-115.6 kJ/mol,反应放热,温度升高,平衡逆向移动,HCl的平衡转化率减低 35.3% 75%
ΔH=-115.6 kJ/mol,反应放热,温度升高,平衡逆向移动,HCl的平衡转化率减低 35.3% 75%
【解析】
(1)①HCl是共价化合物,电子式为![]() ;
;
②根据反应A中,4mol HCl被氧化,放出115.6kJ的热量可知,该反应的热化学方程式为:![]() ΔH=-115.6 kJ/mol;
ΔH=-115.6 kJ/mol;
③ΔH=反应物的总键能-生成物的总键能,即4EH-Cl+EO-O-(2ECl-Cl+4EH-O)=-115.6kJ·mol-1,化简得EH-Cl-EH-O=-32kJ·mol-1<0,即1mol H-O键与断开1mol H-Cl键所需能量相差约32kJ,且H-O键比H-Cl强;
(2)①观察4个投料比的数据,可以看作是O2的量不变,HCl的量依次增加,则HCl的转化率依次降低;在图中,同一温度下,a、b、c、d的HCl的转化率依次降低,且c的转化率在第二个,所以c对应的投料比为2:1;
②从热化学方程式可以看出,该反应是放热反应,升高温度,平衡逆向移动,HCl的转化率减小;
③投料比4:1对应的是曲线b,400℃时,HCl的转化率为75%;设起始时有400mol的HCl,则有100mol O2,则平衡时反应的三段式为(单位:mol)
4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
起 400 100 0 0
转 300 75 150 150
平 100 25 150 150
则平衡时,Cl2的物质的量分数为![]() =35.3%;O2的平衡转化率为
=35.3%;O2的平衡转化率为![]() =75%。
=75%。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
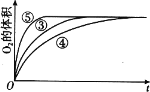
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
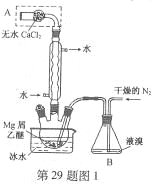
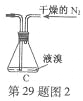
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 | B.洗涤晶体可选用0℃的苯 |
C.加热至160℃的主要目的是除去苯 | D.该步骤的目的是除去乙醚和可能残留的溴 |
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-="===Mg" Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。


