题目内容
由化学能转变的热能或电能仍然是人类使用的主要能源。根据右图所示的装置,判断下列说法不正确的是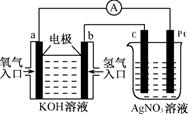
| A.该装置中Pt极为阳极 |
| B.当c极的质量变化了2.16g时,a极上消耗的O2的体积为1.12L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-==2H2O |
| D.该装置中a极为正极,发生还原反应 |
B
解析试题分析:左边是氢氧燃料电池,总反应为2H2+O2=2H2O,通氢气的一极为负极,电极反应式为2H2+2OH--2e-=2H2O,通氧气的一端为正极,电极反应式为O2+2H2O+4e-=4OH-。右边是电解池,c极为阴极,电极反应式为Ag++e-=Ag,Pt极为阳极,电极反应式为2H2O-4e-=4H++O2↑。由电子转移相等得:2H2~O2~4Ag,当c极增重2.16g时,a极消耗的O2为0.005mol,标准状况下为112mL,B错误。
考点:电化学计算
点评:串联电路中,各个电极上通过的电子物质的量相等。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.请回答下列问题:
(1)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599kJ?mol-1,则乙炔的燃烧热为 .
(2)有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来.已知
①CO(g)+
O2(g)═CO2(g)△H1=-283.0kJ?mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
则C(s)+
O2(g)=CO(g)△H= .
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知键能数据如表.
反应N2+3H2?2NH3△H=a kJ?mol-1.试根据表中所列键能数据估算a= .
(1)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599kJ?mol-1,则乙炔的燃烧热为
(2)有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来.已知
①CO(g)+
| 1 |
| 2 |
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
则C(s)+
| 1 |
| 2 |
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知键能数据如表.
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
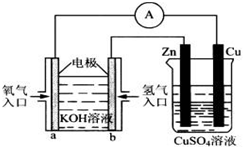 Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液.通过相同电量时,阴极产生的气体物质的量相同的是(填序号)