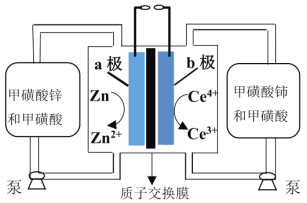
题目内容
【题目】下列实验操作正确的是
A. 制备无水氯化铁
B. 配制一定浓度的硫酸溶液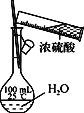
C. 制取少量NH3 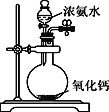
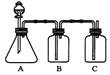
D. 比较NaHCO3和Na2CO3的热稳定性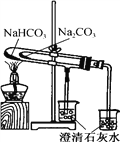
【答案】C
【解析】
A、根据铁离子水解分析;
B、浓硫酸需要在烧杯中稀释并冷却后再转移;
C、根据一水合氨中存在平衡结合氧化钙的性质解答;
D、难分解的应该放在大试管中。
A、氯化铁水解生成氢氧化铁和氯化氢,水解吸热且生成的氯化氢易挥发,所以直接加热不能得到氯化铁晶体,A错误;
B、浓硫酸溶于水放热,需要首先在烧杯中稀释并冷却后再转移至容量瓶中,B错误;
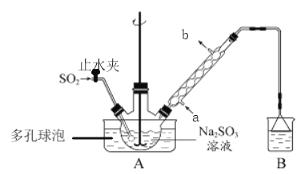
C、浓氨水中存在以下平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入CaO,使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,可以利用该装置制备少量氨气,C正确;
NH4++OH-,加入CaO,使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,可以利用该装置制备少量氨气,C正确;
D、碳酸氢钠受热易分解,要比较碳酸氢钠和碳酸钠的热稳定性,需要把碳酸钠放在大试管中,碳酸氢钠放在小试管中,D错误。答案选C。

练习册系列答案
相关题目