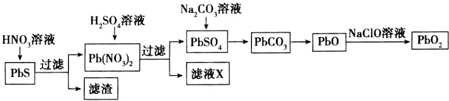
题目内容
17.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | A、B、C三种元素形成的化合物,晶体类型一定相同 | |
| D. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 |
分析 A、B、C、D、E均为短周期主族元素,A元素的某种同位素原子没有中子,则A为H元素;由B、C、D在周期表中的位置关系,可知B、C处于第二周期,D处于第三周期,D元素的原子序数是C的2倍,则C为O元素、D为S元素,可推知B为N元素;E是短周期主族元素中半径最大的元素,则E为Na,据此解答.
解答 解:A、B、C、D、E均为短周期主族元素,A元素的某种同位素原子没有中子,则A为H元素;由B、C、D在周期表中的位置关系,可知B、C处于第二周期,D处于第三周期,D元素的原子序数是C的2倍,则C为O元素、D为S元素,可推知B为N元素;E是短周期主族元素中半径最大的元素,则E为Na.
A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:N3->O2->Na+,故A正确;
B.D、E两种元素可能形成Na2S2,与过氧化钠结构相似,可能含有离子键和共价键,故B正确;
C.A、B、C三种元素形成的化合物有硝酸、硝酸铵等,硝酸属于分子晶体,而硝酸铵属于离子晶体,故C错误;
D.B、D分别和C形成的化合物有氮元素氧化物、二氧化硫等,氮元素氧化物中,有的具有强氧化性,可能使品红溶液褪色,一些氮元素处于中间价态,可能具有较好的还原性,在溶液中可能被溴氧化,二氧化硫具有漂白性,能使品红溶液褪色,具有还原性,能被溴氧化而使溴水褪色,故D正确,
故选:C.
点评 本题位置结构性质关系应用,推断元素是解题关键,D选项为易错点,注意利用氧化还原反应判断其可能性,难度中等.

练习册系列答案
相关题目
2.以下收集气体装置中正确的是( )
| A. |  CO的收集 CO的收集 | B. |  NO的收集(液体为H2O) NO的收集(液体为H2O) | ||
| C. |  O2的收集 O2的收集 | D. |  NH3的收集(液体为H2O) NH3的收集(液体为H2O) |
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
12.某同学对下列四个实验都设计了两种方案,其中两种方案均合理的是( )
| 选项 | A | B | C | D |
| 实验目的 | 清洗铁制品表面的铁锈 | 除去碳酸钠中少量的碳酸氢钠 | 鉴别二氧化氮和溴蒸气 | 检验二氧化碳中含有少量的二氧化硫 |
| 方案1 | 加适量稀盐酸 | 溶解后加盐酸 | 加水 | 通入品红溶液 |
| 方案2 | 用水洗涤 | 加热 | 加硝酸银溶液 | 通入澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
2.只用一种试剂可区别硫酸钠,硫酸镁,氯化铝,氯化铵四种溶液,这种试剂是( )
| A. | 盐酸 | B. | 氢氧化钠 | C. | 氯化钡 | D. | 硝酸银 |
9.下列关于甲烷,乙烯,乙醇,乙酸的说法中,不正确的是( )
| A. | 乙烯可以使溴水褪色,发生加成反应 | |
| B. | 甲烷和氯气在光照条件下反应,反应类型为取代反应 | |
| C. | 乙醇在铜作催化剂并加热条件下生成乙醛,发生还原反应 | |
| D. | 生活中可以用食醋出去水壶中的水垢,主要是利用食醋中醋酸的酸性 |

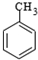 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$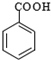
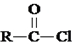
 .
.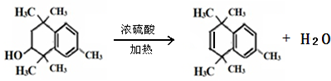 .
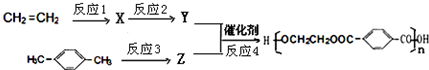
.
 .
.