题目内容
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下: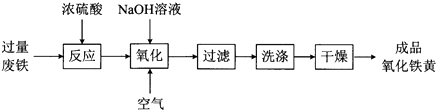
(1)氧化铁黄中铁元素的化合价为 , 废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是(写离子方程式).
(2)氧化过程生成氧化铁黄的化学方程式是 .
(3)上述流程中,检验“洗涤”是否完全的方法是 .
(4)氧化时应控制pH的合理范围是3.5﹣4.0,pH过小导致氧化铁黄产率较低的可能原因是 .
(5)取1g样品进行纯度测试,将其溶解于足量稀盐酸中,后用一定浓度的过量NaOH溶液沉淀其中的铁元素,得到沉淀的质量为Bg,试用所给数据求出产品的纯度 .
【答案】
(1)+3;CO32﹣+H2O?HCO3﹣+OH﹣
(2)4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O
(3)取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净
(4)PH过低导致氧化铁黄部分溶于酸
(5)![]()
【解析】解:过量废铁加入浓硫酸加热溶解得到硫酸亚铁溶液,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,过滤、洗涤、干燥得到成品氧化铁黄,(1)FeOOH种O为﹣2价,H为+1价,则Fe为+3价,废铁表面由防锈的油污,碳酸钠溶液水解显碱性,油脂会在碳酸钠溶液中水解,易于洗涤,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是:CO32﹣+H2OHCO3﹣+OH﹣ , 所以答案是:+3;CO32﹣+H2OHCO3﹣+OH﹣;
(2.)流程分析可知过量铁粉和浓硫酸加热反应生成硫酸亚铁,加入氢氧化钠溶液通入空气发生氧化还原反应生成氧化铁黄,同时生成硫酸钠和水,结合原子守恒和电子守恒配平书写化学方程式为:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O,所以答案是:4FeSO4+O2+8NaOH=4FeOOH+4Na2SO4+2H2O;
(3.)检查洗涤液中是否含有硫酸根离子设计实验检验是否洗涤干净,检验洗涤是否完全的方法是,取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生沉淀,则表明已洗涤干净,否则未洗涤干净,所以答案是:取最后一次洗涤液,加入少量氯化钡溶液,后加入适量稀盐酸,如未观察到白色沉淀,即可证明洗干净;
(4.)氧化时应控制pH的合理范围是保证产率最高,此时的PH范围为:3.5~4.0,pH过小导致产率较低是酸性增强,氧化铁黄会溶解于酸中,所以答案是:PH过低导致氧化铁黄部分溶于酸;
(5.)FeOOH加入盐酸生成氯化铁,然后加入氢氧化钠反应生成氢氧化铁,
反应的关系式为
FeOOH | ~ | Fe(OH)3 |
89 | 107 | |
x | Bg |
x= ![]() g,
g,
则纯度为![]()
![]() =
=![]() ,
,
所以答案是:![]()