��Ŀ����
�ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ�������е�����������Ӧ��������������ܷ�ӦΪ��4Al+3O2+6H2O=4Al(OH)3������˵������ȷ����
- A.������ӦʽΪ��O2+2H2O+4e-=4OH-
- B.��ع���ʱ�����������缫�ص������缫
- C.����״�IJ�Ϊ�������������������ĽӴ����
- D.�õ��ͨ��ֻ��Ҫ������Ϳ��Լ���ʹ��
B
�ӵ���ܷ�Ӧʽ���Կ�������ʧ����Ϊ�������ϣ��䷴ӦʽΪAl-3e-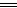 Al3+����O2����������Ӧ����缫��ӦʽΪO2+2H2O+4e-
Al3+����O2����������Ӧ����缫��ӦʽΪO2+2H2O+4e-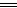 4OH-;��˸õ�ع���ʱ����Ӧ�����ص������缫����A��ȷ��B������״������������O2�ĽӴ������C��ȷ����Al���뷴Ӧ���ܽ����������O2�����ڿ������迼�ǣ�����D��ȷ��
4OH-;��˸õ�ع���ʱ����Ӧ�����ص������缫����A��ȷ��B������״������������O2�ĽӴ������C��ȷ����Al���뷴Ӧ���ܽ����������O2�����ڿ������迼�ǣ�����D��ȷ��
�ӵ���ܷ�Ӧʽ���Կ�������ʧ����Ϊ�������ϣ��䷴ӦʽΪAl-3e-
 Al3+����O2����������Ӧ����缫��ӦʽΪO2+2H2O+4e-
Al3+����O2����������Ӧ����缫��ӦʽΪO2+2H2O+4e- 4OH-;��˸õ�ع���ʱ����Ӧ�����ص������缫����A��ȷ��B������״������������O2�ĽӴ������C��ȷ����Al���뷴Ӧ���ܽ����������O2�����ڿ������迼�ǣ�����D��ȷ��
4OH-;��˸õ�ع���ʱ����Ӧ�����ص������缫����A��ȷ��B������״������������O2�ĽӴ������C��ȷ����Al���뷴Ӧ���ܽ����������O2�����ڿ������迼�ǣ�����D��ȷ�� 
��ϰ��ϵ�д�
 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
�����Ŀ
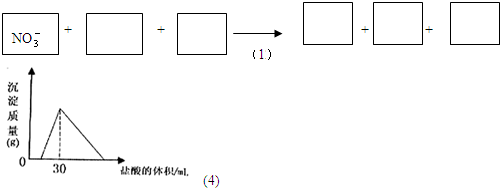
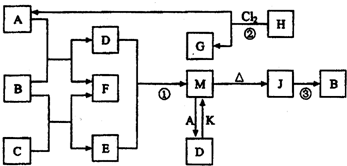 ��1��C�д��ڵĻ�ѧ������Ϊ
��1��C�д��ڵĻ�ѧ������Ϊ