题目内容
为使反应:Cu+2H2O===Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
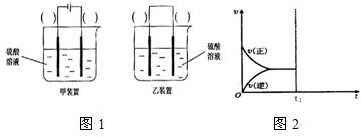
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
【答案】
C
【解析】
试题分析:金属铜和水之间发生的反应是非自发的氧化还原反应,应设计成电解池,在反应
Cu+2H2O=Cu(OH)2↓+H2↑中,失电子的是金属铜,所以必须选择金属铜作阳极材料,其他导电的物质做阴极材料即可,在阴极上应该是水中的氢离子得电子的反应,可以选择硫酸钠等来做电解质. A、原电池原理不能实现该非自发的氧化还原反应,所以A错误; B、铜锌合金在潮湿的空气中发生电化学腐蚀时,金属锌被腐蚀,铜被保护,所以B错误;C、用铜片作阴、阳电极,电解硫酸钠溶液,可以实现该反应的发生,所以C正确;D、以铜为电极电解硫酸铜溶液的原理是在阴极上析出金属铜,不会产生氢气,所以D错误。
考点:电解池与原电池
点评:本题需要把每个选项所能形成的电解池分析清楚,选择一个合适题意的选项。需要考虑到放电顺序。

练习册系列答案
相关题目