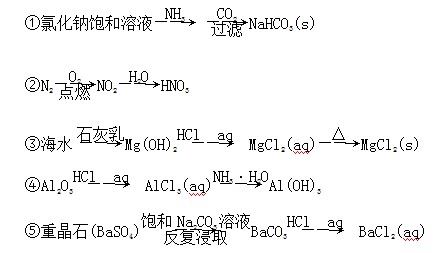
题目内容
根据下列实验现象,所得结论正确的是
A B C D

A B C D
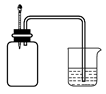
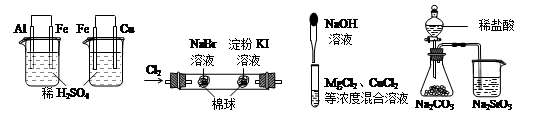
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 先生成蓝色沉淀,后产生白色沉淀 | 溶度积常数:Mg(OH)2<Cu(OH)2 Cu(OH)2Mg(OH)2<Cu(OH)2MgMg(OH)2<Cu(OH)2Mg(OH)2<Cu(OH)2 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A
试题分析:A.由于左右两个烧杯都构成了原电池,在左边的烧杯中,由于活动性Al>Fe,所以Al作负极,发生氧化反应而被腐蚀,溶液中的H+在Fe上得到电子而被还原为氢气,因此左烧杯中铁表面有气泡;在右边的烧杯中,由于活动性Fe>Cu, Fe作负极,发生氧化反应而被腐蚀,溶液中的H+在Cu上得到电子而被还原为氢气,因此右烧杯中铜表面有气泡;因此金属的活动性Al>Fe>Cu。正确。B.发生的反应为:Cl2+2NaBr=2NaCl+Br2;Cl2+2KI=2KCl+I2。I2遇淀粉变蓝色。也可能发生反应:Br2+2KI=2NaBr+I2。错误。C.向MgCl2、CuCl2的混合溶液中加入NaOH溶液,由于首先产生蓝色的Cu(OH)2沉淀,说明溶度积常数Ksp(Cu(OH)2)< Ksp(Mg(OH)2).错误。D.由于酸性HCl> H2CO3> H2SiO3。所以会发生反应Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓。由于盐酸有挥发性,所以CO2气体中可能会含有HCl,因此也可能发生反应:Na2SiO3+2HCl=H2SiO3↓+2NaCl。元素的非金属性越强,其最高价含氧酸的酸性就越强,因此不能根据HCl的酸性强弱来判断元素的非金属性的强弱。错误。

练习册系列答案
相关题目

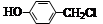 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。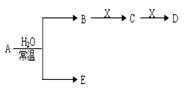
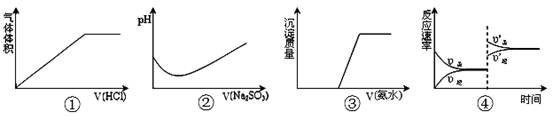
 2SO3达平衡后,升高温度
2SO3达平衡后,升高温度 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。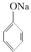 +SO2+H2O→
+SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚
+Na2SO3,说明给出质子能力:HSO3->苯酚 CaSiO3+CO2↑,说明非金属性:碳>硅
CaSiO3+CO2↑,说明非金属性:碳>硅