题目内容
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
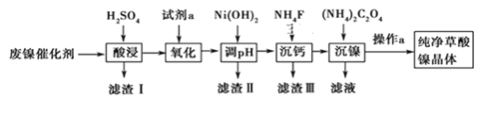
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)在酸浸过程中会适当增大酸的浓度并不断快速搅拌,目的是______________。
(2)写出“沉镍”时发生反应的离子方程式:______________________________,当Ca2+沉淀完全时,溶液中 c(F-)> ________mol·L-1(写出计算式即可)。
(3)试剂a是一种绿色氧化剂,写出“氧化”时反应的化学反应方程式:_______________________________。
(4)操作a的内容包括过滤,洗涤,干燥。请用简洁语言描述洗涤的方法是__________________________。
(5)“调pH”时pH的调控范围为______≤PH<6.8。
【答案】提高“酸浸”速率 Ni2++C2O42-+2H2O=![]()
![]() 2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O 过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次 5.0
【解析】
废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸;试剂a是一种绿色氧化剂,a是H2O2, H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al)OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,据此答题。
(1)根据影响化学反应速率的因素可知,适当增大酸的浓度并不断快速搅拌,可提高浸出率;
(2)向NiSO4溶液中加入(NH4)2C2O4,得到草酸镍沉淀,“沉镍”时反应的离子方程式为:Ni2++C2O42-+2H2O=![]() ,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>
,当Ca2+沉淀完全时,Ca2+的浓度小于1.0×10-5 mol·L-1,根据氟化钙的溶度积常数,溶液中 c(F-)>![]() ;
;
(3)试剂a是一种绿色氧化剂,所以加入的a是H2O2,亚铁离子被氧化成铁离子,所以“氧化”时反应的化学反应方程式为2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2H2O;
(4)操作a的内容包括过滤,洗涤,干燥。洗涤沉淀的方法是过滤结束后,沿玻璃棒往漏斗中注水至淹没沉淀待水自然流下,重复操作2-3次;
(5)根据表中的数据可知,pH为5.0时,Fe3+、Al3+沉淀完全,pH为6.8时Ni2+开始沉淀,所以pH的调控范围为5.0≤PH<6.8。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___。已知:K300℃>K350℃,则该反应是___热反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂