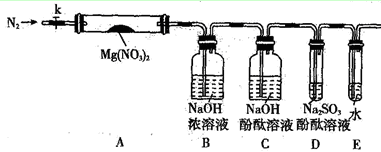
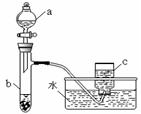
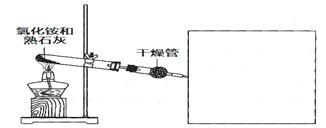
题目内容
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有氢气生成,下列叙述正确的是
| A.NH4H是共价化合物 |
| B.NH4H溶于水所形成的溶液显酸性 |
| C.NH4H与水反应时,NH4H是氧化剂 |
| D.NH4H固体投入少量水中,有两种气体生成 |
D
试题分析:A、NH4H与氯化铵结构相似,则应为离子化合物,错误;B、NH4H + H2O = NH3·H2O + H2↑,生成的NH3·H2O使溶液呈碱性,错误;C、NH4H中H由–1价升高到0价生成H2,被氧化,作还原剂,错误;D、水的量较少时,生成的NH3·H2O浓度大,易分解生成氨气,同时生成氢气,正确。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目

 2KNO2+O2↑
2KNO2+O2↑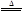 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑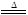 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑