��Ŀ����
8���л���X����������ζ����һ����Ҫ��ʳƷ���Ӽ����о���ԱΪ��ȷ��X����ɺͽṹ����������ʵ�飺��30.4g�л���X��ȫȼ�գ��������88g������̼��28.8gˮ��������������Է�������Ϊ152������������Ȼ�̼��Һ����Һ��ɫ������������Һ������ˮԡ�����ȣ��۲쵽����������������KMnO4������Һ����ɫ���õ�������������A��B��C��������������ͺ˴Ź�������������������BΪ ��CΪHOOC-COOH��A�ĺ������ͼ�ͺ˴Ź�������ͼ��ͼ1��
��CΪHOOC-COOH��A�ĺ������ͼ�ͺ˴Ź�������ͼ��ͼ1��
��֪��RCHO$\stackrel{KMnO_{4}��H+��}{��}$RCOOH

��ش�
��1��X�ķ���ʽ��C10H16O��
��2��X�����к��еĹ����ŵ�������̼̼˫����ȩ����X���ܷ����ķ�Ӧ��acd������ţ���
a���ӳɷ�Ӧ b����ȥ��Ӧ c��������Ӧ d����ԭ��Ӧ
��3��A�Ľṹ��ʽ��CH3COCH3��
��4���л���������Ҫ�ɷ��Ǿۼ���ϩ��������ṹ��ʽ���£�����ҵ�ϳ���AΪԭ�Ͻ��кϳɣ��ϳ�·����ͼ2��ʾ��

��֪��

��M�Ľṹ��ʽ��
 ��
����P�Ľṹ��ʽ��CH2=C��CH3��COOH��
���� ��1��30.4g�л���X�����ʵ���Ϊ$\frac{30.4g}{152g/mol}$=0.2mol����ȫȼ�գ�����88g������̼��28.8gˮ����2mol������̼��1.6molˮ������1molX�к���10molCԭ�Ӻ�16molHԭ�ӣ�����Է�������Ϊ152��Ӧ�û���Oԭ�Ӹ���Ϊ$\frac{152-12��10-16��1}{16}$=1���ݴ˷��������ʽ��
��2��X�м���������Ȼ�̼��Һ����Һ��ɫ������������Һ������ˮԡ�����ȣ��۲쵽����������������KMnO4������Һ����ɫ���õ�������������A��B��C��������������ͺ˴Ź�������������������BΪ  ��CΪHOOC-COOH����֪X�к���̼̼˫����ȩ����
��CΪHOOC-COOH����֪X�к���̼̼˫����ȩ����
��3����A�ĺ������ͼ�ͺ˴Ź�������ͼ��֪��A��ֻ��1��Hԭ���Һ���C=O����
��4���ݹ�ҵ����AΪԭ�Ͻ��кϳ��л������ĺϳ�·��ͼ��֪��A��HCN�����ӳɷ�Ӧ���ɵ�MΪ ��
�� ˮ������2-��-2-�ǻ����ᣬ2-��-2-�ǻ����ᷢ����ȥ��Ӧ����2-����ϩ�ᣬ2-����ϩ����״�����������Ӧ���ɵ�QΪCH2=C��CH3��COOCH3��Q�����Ӿ۷�Ӧ���ɾۼ���ϩ�������
ˮ������2-��-2-�ǻ����ᣬ2-��-2-�ǻ����ᷢ����ȥ��Ӧ����2-����ϩ�ᣬ2-����ϩ����״�����������Ӧ���ɵ�QΪCH2=C��CH3��COOCH3��Q�����Ӿ۷�Ӧ���ɾۼ���ϩ�������
��� �⣺��1��30.4g�л���X�����ʵ���Ϊ$\frac{30.4g}{152g/mol}$=0.2mol����ȫȼ�գ�����88g������̼��28.8gˮ����2mol������̼��1.6molˮ������1molX�к���10molCԭ�Ӻ�16molHԭ�ӣ�����Է�������Ϊ152��Ӧ�û���Oԭ�Ӹ���Ϊ$\frac{152-12��10-16��1}{16}$=1�����������ʽΪC10H16O���ʴ�Ϊ��C10H16O��
��2��X�м���������Ȼ�̼��Һ����Һ��ɫ������������Һ������ˮԡ�����ȣ��۲쵽����������������KMnO4������Һ����ɫ���õ�������������A��B��C��������������ͺ˴Ź�������������������BΪ  ��CΪHOOC-COOH����֪X�к���̼̼˫����ȩ����̼̼˫���ܹ������ӳɷ�Ӧ��ȩ�����ܹ�������ԭ��Ӧ���ܹ�����������Ӧ���ʴ�Ϊ��̼̼˫����ȩ����acd��
��CΪHOOC-COOH����֪X�к���̼̼˫����ȩ����̼̼˫���ܹ������ӳɷ�Ӧ��ȩ�����ܹ�������ԭ��Ӧ���ܹ�����������Ӧ���ʴ�Ϊ��̼̼˫����ȩ����acd��
��3����A�ĺ������ͼ�ͺ˴Ź�������ͼ��֪��A��ֻ��1��Hԭ���Һ���C=O����X�к���10��Cԭ�ӣ������Ը��������������BΪ  ��CΪHOOC-COOH��A������AΪCH3COCH3���ʴ�Ϊ��CH3COCH3��
��CΪHOOC-COOH��A������AΪCH3COCH3���ʴ�Ϊ��CH3COCH3��
��4���ݹ�ҵ����AΪԭ�Ͻ��кϳ��л������ĺϳ�·��ͼ��֪��A��HCN�����ӳɷ�Ӧ���ɵ�MΪ ��
�� ˮ������2-��-2-�ǻ����ᣬ2-��-2-�ǻ����ᷢ����ȥ��Ӧ����2-����ϩ��CH2=C��CH3��COOH��CH2=C��CH3��COOH��״�����������Ӧ���ɵ�QΪCH2=C��CH3��COOCH3��Q�����Ӿ۷�Ӧ���ɾۼ���ϩ��������ʴ�Ϊ����
ˮ������2-��-2-�ǻ����ᣬ2-��-2-�ǻ����ᷢ����ȥ��Ӧ����2-����ϩ��CH2=C��CH3��COOH��CH2=C��CH3��COOH��״�����������Ӧ���ɵ�QΪCH2=C��CH3��COOCH3��Q�����Ӿ۷�Ӧ���ɾۼ���ϩ��������ʴ�Ϊ���� ����CH2=C��CH3��COOH��
����CH2=C��CH3��COOH��
���� ���⿼���л�����ƶϣ���Ŀ�Ѷ��еȣ�����Ĺؼ����Ǹ��ݾۼ���ϩ�����Ϊ�����㣬������ʵĹ����ŵı仯�����ƶϣ�ע����չ����ŵ����ʣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ��ϩʹ��ˮ�����Ը��������Һ��ɫ�����ڼӳɷ�Ӧ | |
| B�� | ���³�ѹ�»�����ϩ ��һ��������ˮ����ɫ���� ��һ��������ˮ����ɫ���� | |
| C�� | �������ظ������Һ����Ƽݣ������ķ�Ӧ�����Ҵ���������Ӧ | |
| D�� | ����������ϩ���Ҵ���ȫȼ�գ�����O2�����ʵ�����ͬ |
| A�� | ���ԭ��������Ar��K | B�� | ���ԣ�NaOH��Mg��OH��2 | ||
| C�� | ���ԣ�HNO3��H3PO4 | D�� | Ԫ�طǽ����ԣ�Cl��S |
��H2O��g���TH2O��l����H=-Q1kJ��mol-1
��C2H5OH��g���TC2H5OH��1����H=-Q2kJ��mol-1
��C2H5OH��g���T302��g��=2C02��g��+3H20��g����H=-Q3 kJ��mol-1
�����ж���ȷ���ǣ�������
| A�� | �ƾ���ȼ����AH=-Q3 kJ•mol-1 | |
| B�� | �ɢۿ�֪1molC2H5OH��g������������2molC02��g����3 molH20��g���������� | |
| C�� | H20��g����H20�� 1���ͷų������������Ըù���Ϊ���ȷ�Ӧ | |
| D�� | 23gҺ��ƾ���ȫȼ������C02��g����H20�� 1�����ͷ�����Ϊ��0.5Q3-0.5Q2+1.5Q1��kJ |
| A�� | v��A��=0.15mol/��L•min�� | B�� | v��B��=0.3 mol/��L•min�� | ||
| C�� | v��C��=0.2 mol/��L•min�� | D�� | v��D��=0.1 mol/��L•min�� |
����ϵ��ѹǿ���ٸı�
����ϵ���¶Ȳ��ٸı�
�۸���ֵ�Ũ�Ȳ��ٸı�
�ܸ���������������ٸı�
�ݷ�Ӧ����v��A����v��B����v��C����v��D��=m��n��p��q
��λʱ����m molA�ϼ���Ӧ��ͬʱpmolCҲ�ϼ���Ӧ
����ϵ���ܶȲ��ٱ仯��
| A�� | �ۢܢݢ� | B�� | �ڢۢܢ� | C�� | �٢ۢܢ� | D�� | �ۢܢޢ� |
 ���ۼ����м���֮˵��������ָ��1mol���ۼ�����Ҫ���յ��������γ�1mol���ۼ����ų���������
���ۼ����м���֮˵��������ָ��1mol���ۼ�����Ҫ���յ��������γ�1mol���ۼ����ų�����������1����֪H-Cl���ļ���Ϊ431.4kJ/mol�����й��ڼ��ܵ�������ȷ����AD��
A��ÿ����1mol H-Cl���ų�431.4kJ���� B��ÿ����1mol H-Cl������431.4kJ����
C��ÿ��1mol H-Cl���ų�431.4kJ���� D��ÿ��1mol H-Cl������431.4kJ����
��2���ο��±��е����ݣ��ж����з�������ʱ���ȶ�����A��
| ��ѧ�� | H-H | H-F | H-Cl | H-Br |
| ����/kJ/mol | 436 | 565 | 431 | 368 |
��3�����ü��ܴ�С���͵���A��
A�������Ļ�ѧ���ʱ������ȶ�
B�����³�ѹ�£����Һ̬����ʹ�̬
C��ϡ������һ����ѷ�����ѧ��Ӧ
D�������ӷ��������ѻӷ�
��4����֪��4HCl+O2�T2Cl2+2H2O���÷�Ӧ�У�4mol HCl���������ų�115.6kJ���������Ͽ�1mol H-O����Ͽ�1mol H-Cl�������������ԼΪ31.9kJ��
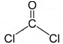 �����ӵ����幹����ƽ�������Σ�
�����ӵ����幹����ƽ�������Σ�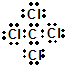 ����CCl4��Ϊ�ȵ�����ķ��Ӻ����ӷֱ���SiCl4��SO42-������һ����д��ѧʽ����
����CCl4��Ϊ�ȵ�����ķ��Ӻ����ӷֱ���SiCl4��SO42-������һ����д��ѧʽ����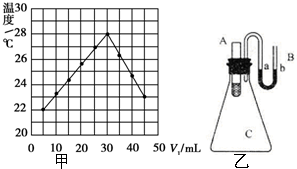 ʵ���⣺��V1 mL 1.0mol•L-1HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ����V1+V2=50mL�����밴Ҫ����գ�
ʵ���⣺��V1 mL 1.0mol•L-1HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ����V1+V2=50mL�����밴Ҫ����գ�