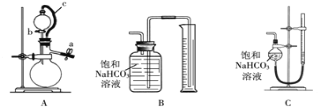
题目内容
【题目】[选做题——物质结构与性质]
金属钛(Ti)是一种具有许多优良性能的的金属,钛和钛合金被认为是21世纪的重要金属材料。
(l) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
① Ti2+基态的电子排布式可表示为_____________________。
② BH4-的空间构型是______________________(用文字描述)。
③ 与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有__________种。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。
①纳米TiO2催化的一个实例如下图所示。
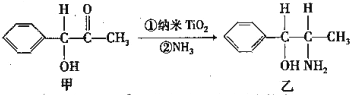
化合物甲的分子中采取![]() 杂化方式的碳原子个数为______________, 化合物乙中采取
杂化方式的碳原子个数为______________, 化合物乙中采取![]() 杂化的原子的第一电离能由小到大的顺序为________________。
杂化的原子的第一电离能由小到大的顺序为________________。
②在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为_________________、_______________(各写一种)。
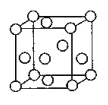
(3)金属钛内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为![]()
![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则该晶胞的边长为______________cm。
,则该晶胞的边长为______________cm。
【答案】(1)①1s22s22p63s23p63d2 ;②正四面体;③ 3;(2)①7,C〈 O〈 N;②CO2(或N2O、CS2、BeCl2等合理均可给分),SCN-;(3)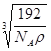 。
。
【解析】试题分析:(1)①Ti位于元素周期表,第四周期IVB族,属于22号元素,因此Ti2+的电子排布式为:1s22s22p63s23p63d2 ;②BH4-含有4个σ键,孤电子对数(3+1-4)/2=0,价层电子对数为4,空间构型为正四面体;③Ti的价电子排布式是3d24S2,Ti的未成对电子对数为2个,同周期含有2个未成对电子的是Ni(3d84s2)、Ge(4s24p2)、Se(4s24p4)共有3种元素;(2)①苯环上的碳原子是sp2杂化,sp2杂化应有3个σ键,即羰基上的碳原子是sp2杂化,因此共有7个,进行sp3杂化说明价层电子对数是4,即苯环侧链上的C和N,O有2个σ,2个孤电子对,价层电子对数也是4,杂化类型为sp3,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此大小顺序是C<O<N;②等电子体:原子总数相等,价电子数相同的微粒,因此与CNO-等电子体的是CO2、N2O、CS2、BeCl2、SCN-等;(3)晶胞中Ti的个数,Ti位于顶点的8×1/8=1,位于面上:6×1/2=3,共有4个,晶胞的质量为4×48/NAg,根据密度的定义,边长为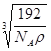 。
。