题目内容
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
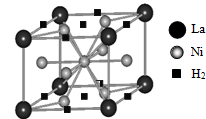
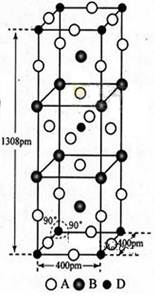
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。

(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
(1)
(2)K;F
(3)①K2NiF4;6;②3.4
(4)离子键和配位键;[FeF6]3-;F-

(2)K;F
(3)①K2NiF4;6;②3.4
(4)离子键和配位键;[FeF6]3-;F-
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F;
(3)①该晶胞中A原子个数=16×1/4+4×1/2+2=8,B原子个数=8×1/4+2=4,D原子的个数=8×1/8+1=2,故该化合物的化学式为K2NiF4;由晶体的结构,D的配位数是6;
②该晶胞的体积=(400×10-10cm)2(1308×10-10cm)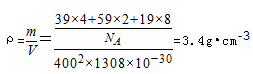
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-。
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为;

(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F;
(3)①该晶胞中A原子个数=16×1/4+4×1/2+2=8,B原子个数=8×1/4+2=4,D原子的个数=8×1/8+1=2,故该化合物的化学式为K2NiF4;由晶体的结构,D的配位数是6;
②该晶胞的体积=(400×10-10cm)2(1308×10-10cm)
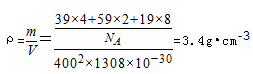
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目