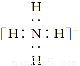题目内容
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
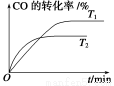
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。
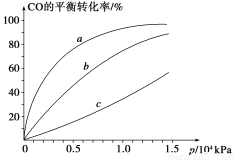
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)??CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)??CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
(1)ΔH1+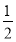 ΔH2-
ΔH2-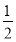 ΔH3
ΔH3
(2)①> ②350 1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失 ③AD
(3)0.125 mol·L-1·min-1 4 D
【解析】(1)根据盖斯定律可得,ΔH=ΔH1+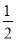 ΔH2-
ΔH2-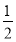 ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)??CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)
ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)??CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)  CO(g)+2H2(g)的K1=
CO(g)+2H2(g)的K1=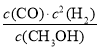 =
=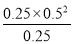 =0.52=0.25,而反应CO(g)+2H2(g)
=0.52=0.25,而反应CO(g)+2H2(g)  CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
CH3OH(g)的平衡常数K=1/K1=1/0.25=4。

 小题狂做系列答案
小题狂做系列答案某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是________。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为
Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验:。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为________。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:______________。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是________________。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:__________。
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2 中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。