题目内容
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
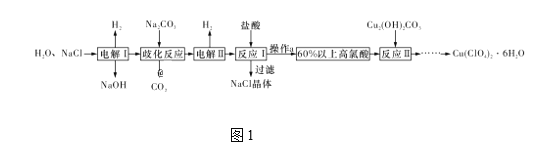
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
【答案】阳 3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2 ClO4- 蒸发浓缩 ![]() 100% 2Cu(ClO4)2
100% 2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
【解析】
根据题意可知,本题考查电化学原理,运用原电池和电解池原理分析。
(1)“电解I”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,需要防止氢氧根离子与氯气反应,所以用的交换膜是阳离子交换膜;
故答案为:阳;
(2)“歧化反应”是碳酸钠与氯气反应生成氯化钠和NaClO3,氯元素从0价变为1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2;
故答案为:3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2;
(3)通过电解,溶液中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解II”的阳极的氯离子失电子产物为ClO4-;
故答案为:ClO4-;
(4)加入盐酸,过滤除去氯化钠晶体,通过蒸发浓缩即可得到60%以上的高氯酸,
故答案为:蒸发浓缩;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠反应生成氯酸钠和氯化钠,电解后氯酸钠变成高氯酸钠,加入盐酸反应生成高氯酸,最后与Cu2(OH)2CO3反应生成Cu(ClO4)26H2O,假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1mol氯酸钠,根据氯元素守恒最终可以得到0.5molCu(ClO4)26H2O,因此产率为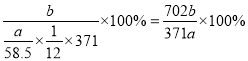 ;
;
故答案为:![]() 100%;
100%;
(6)在A方式:![]() 中CuCl2是还原产物,O2是氧化产物,反应中转移电子数为16e,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,则方式A共转移4mol×16e=64mole,A、B两种方式转移的电子数之比为8:7,则B中转移电子64mole×
中CuCl2是还原产物,O2是氧化产物,反应中转移电子数为16e,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,则方式A共转移4mol×16e=64mole,A、B两种方式转移的电子数之比为8:7,则B中转移电子64mole×![]() =56mole,Cu(ClO4)2分解时Cu元素化合价不变,则B方式中O2是氧化产物,生成O2的物质的量为
=56mole,Cu(ClO4)2分解时Cu元素化合价不变,则B方式中O2是氧化产物,生成O2的物质的量为![]() ,若Cl元素还原产物中价态为x价,则8(7x)=56,解得:x=0,可知还原产物为Cl2,且其物质的量为
,若Cl元素还原产物中价态为x价,则8(7x)=56,解得:x=0,可知还原产物为Cl2,且其物质的量为![]() ,则结合原子守恒,B方式发生反应的方程式为2Cu(ClO4)2
,则结合原子守恒,B方式发生反应的方程式为2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑;
2CuO+7O2↑+2Cl2↑;
故答案为:2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑。
2CuO+7O2↑+2Cl2↑。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案