题目内容
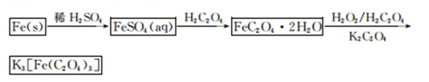
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题:
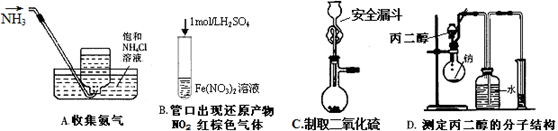
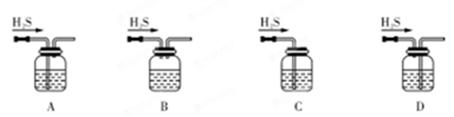
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 (填序号)。
(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是 。
(4)C2O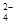 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 。
②下列滴定操作中使滴定结果偏高的是 (填序号)。
③取产物10.0 g配成100 mL溶液,从中取出20 mL于锥形瓶中,用浓度为0.1mol·L-l的酸性KMnO4溶液滴定,达到滴定终点时消耗酸性KMnO4溶液24.00mL,则产物中K3 [Fe(C2O4)3]·3H2O的质量分数为 [已知摩尔质量M{ K3[Fe(C2O4)3]·3H2O)="491" g·mol-l]。

(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 (填序号)。

(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是 。
(4)C2O
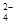 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。①写出滴定过程中发生反应的离子方程式 。
②下列滴定操作中使滴定结果偏高的是 (填序号)。
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
(1)A(2)抑制Fe2+的水解 三草酸合铁酸钾难溶于乙醇,便于析出;(3)确保结晶水全部失去;
(4)①5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;②AC ③49.1%
(4)①5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;②AC ③49.1%
试题分析::(1)该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,故A正确;硫化氢与氢氧化钠接触面积较小,所以吸收不完全,故B错误;没有排气装置,导致该装置内气压增大而产生安全事故,故C错误;该装置中应遵循“长进短出”的原理,故D错误;所以选A;
(2)硫酸亚铁易水解而是其气压呈酸性,加热稀硫酸能抑制亚铁离子水解;双氧水不稳定,温度高时,双氧水易分解,为防止双氧水分解,温度应低些,根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,所以可以用乙醇使三草酸合铁酸钾析出;
(3)晶体易吸水,为防止吸水步骤③需要在干燥器中进行,步骤⑤的是检验晶体中的结晶水是否已全部失去;
(4)①化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等,得到离子方程式为5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
②A.滴定管没有用标准液润洗,浓度减小,消耗的标准液体积比实际体积变大,测定结果偏高;
B.锥形瓶未润洗,所取待测液的量没变,故不影响V(标准),所以滴定结果无影响
C.由于气泡的体积计入了标准液消耗的体积,使得标准液体积比实际体积增大,测定结果偏高;
D.读取标准液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,测定结果偏低;
故选AC.
③ 5K3[Fe(C2O4)3]·3H2O ~ 15C2O42- ~ 6MnO4-
5×491g 6mol
x 24.00mL×10-3×0.1mol·L-l
x =0.982
K3 [Fe(C2O4)3]·3H2O的质量分数0.982/2×100%=49.1%

练习册系列答案
相关题目