题目内容
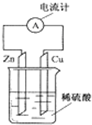
如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)A中反应的离子方程式是______.
(2)B中Cu极的电极反应式是______.
Cu极附近溶液的pH______(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是______(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的顺序是______(用“>”表示).
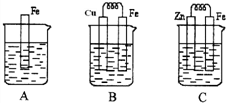
(1)A中反应的离子方程式是______.
(2)B中Cu极的电极反应式是______.
Cu极附近溶液的pH______(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是______(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的顺序是______(用“>”表示).

(1)硫酸、硫酸亚铁是可溶性的强电解质,写离子,铁、氢气是单质写化学式,铁和稀硫酸反应生成硫酸亚铁和氢气.
故答案为:Fe+2H+=Fe2++H2↑
(2)B中Cu作正极,氢离子在铜极上得电子生成氢气,反应还原反应;氢离子在铜极上生成氢气,使溶液中的氢离子浓度降低,所以PH增大.
故答案为:2H++2e_=H2↑;增大.
(3)C中锌作负极,锌失电子变成离子进入溶液,所以被腐蚀的是锌;A中铁和稀硫酸反应;B中铁作负极,加快铁的腐蚀;C中铁作正极,减慢铁的腐蚀.
故答案为:Zn;B>A>C
故答案为:Fe+2H+=Fe2++H2↑
(2)B中Cu作正极,氢离子在铜极上得电子生成氢气,反应还原反应;氢离子在铜极上生成氢气,使溶液中的氢离子浓度降低,所以PH增大.
故答案为:2H++2e_=H2↑;增大.
(3)C中锌作负极,锌失电子变成离子进入溶液,所以被腐蚀的是锌;A中铁和稀硫酸反应;B中铁作负极,加快铁的腐蚀;C中铁作正极,减慢铁的腐蚀.
故答案为:Zn;B>A>C

练习册系列答案
相关题目