题目内容
【题目】(15分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图:
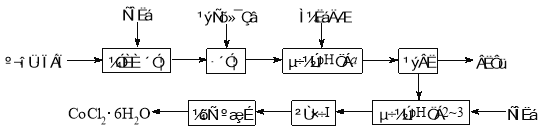
已知:
① 钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
② CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110 ~120℃时,失去结晶水变成有毒的无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为_______________________。
(2)加入碳酸钠调节pH至a,a的范围是________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是____________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____________ ___。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行 _操作。
【答案】(1)减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(2分)。
(2)5.2~7.6(3分);(3)蒸发浓缩、冷却结晶(2分)
(4)降低烘干温度,防止产品分解(2分)
(5)样品中含有NaCl杂质;烘干时失去了部分结晶水(3分) (6)蒸馏(3分)
【解析】
试题分析:(1)硝酸和金属反应生成氮的氧化物,氮的氧化物对环境有危害,同时实验制备CoCl2·6H2O,加入硝酸将会引入NO3-,产物不纯净;
(2)加入碳酸钠,调节pH,除去杂质,根据阳离子氢氧化物形式沉淀时溶液的pH,因此a的范围是5.2~7.6;
(3)因为得到物质含有结晶水,因此采用蒸发结晶、冷却结晶、过滤;
(4)根据信息,加热到110~120℃,失去结晶水变为有毒的无水氯化钴,因此采用减压烘干;
(5)因为在流程中加入碳酸钠,后加入盐酸,反应后溶液中有NaCl,NaCl和硝酸银反应生成AgCl,因此计算出的产品质量偏大,氯化钴的晶体加热过程中失去水,使样品质量减少,因此计算结果偏大;(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行过滤;蒸馏操作。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案