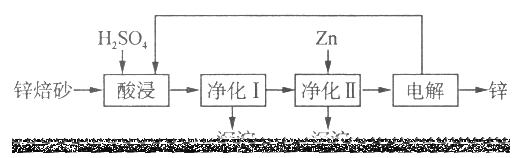
题目内容
【题目】下列有关电子云的叙述中,正确的是( )
A. 电子云形象地表示了电子在核外某处单位体积内出现的概率
B. 电子云直观地表示了核外电子的数目
C. 1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D. 电子云是电子绕核运动形成了一团带负电荷的云雾
【答案】A
【解析】试题分析:为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在原子核外出现几率的大小;点密集的地方,表示电子出现的几率大;点稀疏的地方,表示电子出现的几率小,这就是电子云。1s电子云界面以外,电子出现的概率(几率)不为零,只是出现的几率很小。选项A符合题意。

练习册系列答案
相关题目