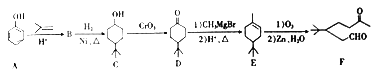
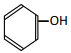
题目内容
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )

A. 原子半径:X<Y<Z B. 气态氢化物的稳定性:X>Z
C. 非金属性:Y>Z D. 最高价氧化物对应水化物的酸性:W > Y
【答案】D
【解析】由元素在周期表的位置可知,X为Si元素、Y为N元素、Z为O元素、W为Cl元素,
A、同周期自左而右原子半径减小,电子层越多原子半径越大,所以原子半径的大小顺序为:X>Y>Z,故A错误;B、同一周期中,元素的非金属性随着原子序数的增大而增强,同一主族中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,其氢化物越稳定,X是Si元素,Z是N元素,N元素的非金属性大于P元素,P元素的非金属性大于Si,所以N元素的非金属性大于Si元素,则气态氢化物的稳定性:Z>X,故B错误;C、同一周期中,元素的非金属性随着原子序数的增大而增强,非金属性:Y<Z ,故C正确;D、同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,Y的非金属性小于W,所以W的最高价氧化物的水化物酸性大于Y,故D正确。故选D。

 小学教材全测系列答案
小学教材全测系列答案【题目】一定温度下,在三个体积均为1 L的恒容密闭容器中发生如下反应:A(g)+2B2(g)![]() C(g)
C(g)
其中容器Ⅰ中的反应在5 min时达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
A(g) | B2(g) | C(g) | C(g) | ||
Ⅰ | 500 | 0.5 | 1.0 | 0 | 0.4 |
Ⅱ | 500 | a | b | 0.25 | 0.4 |
Ⅲ | 600 | 0.25 | 0.5 | 0.25 | 0.35 |
下列说法不正确的是
A. 容器Ⅰ中的反应在前5 min的平均反应速率v(A)=0.08 mol·L-1·min-1
B. 该反应的正反应为放热反应
C. 容器Ⅱ中起始时a=0.25,b=0.5
D. 若起始时向容器Ⅰ中加入A 0.8 mol、B2 1.6 mol,达到平衡时A的转化率为80%
【题目】乙酰苯胺,白色有光泽片状结晶或白色结晶粉未,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。制备原理如下:
C6H5-NH2+ CH3COOH![]() C6H5-NH-CO-CH3+ H2O
C6H5-NH-CO-CH3+ H2O
熔点:-6.2℃ | 供点:16.6℃ | 熔点:114.3℃ |
沸点:184.4℃ | 沸点:117.9 ℃ | 沸点:304℃ |
相对分子量:93 | 相对分子量:60 | 相对分子量:135 |
微溶于水 | 密度:1.050g·mL-1 | 微溶于冷水,溶于热水 |
易被氧化 | 呈中性或极弱碱性,遇酸或碱性水溶液易分解成 | |
密度:1.0217 g·mL-1 | 苯胺及乙酸 |

实验步骤为:
a.在圆底烧瓶中加入10mL新蒸馏制得的苯胺、15 mL冰醋酸和少许锌粉(约0.2g)和几粒沸石,并连接好装置。
b.用小火加热回流,保持温度在105℃约1小时,当温度下降时表明反应已完成,边搅拌边趁热过滤,然后将反应物倒入盛有250 mL冷水的烧杯中。
c.冷却后抽滤,用冷水洗涤粗产品,将粗产品移至400 mL烧杯中,加入300 mL水并加热使其充分溶解,稍冷,待乙酰苯胺晶体析出,抽滤后压干并称重为12.58 g。
回答下列问题:
(1)A仪器的名称是______________,刺形分馏柱的作用是____________。
(2)加入的锌粉与醋酸反应,化学方程式为____________;其目的是__________________。
(3)从粗产品到晶体,采用的实验方法是____________(填字母)。
A.过滤 B.结晶 C.重结晶 D.抽滤
(4)本实验提高产率的主要措施有____________、____________。
(5)实际产率是____________(保留两位有效数字)。