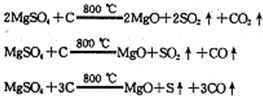题目内容
(19分)黄铜矿的主要成分是CuFeS2(硫元素显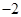 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:

已知:

 =
=
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
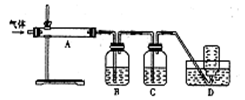
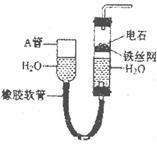
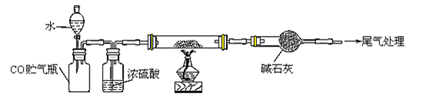
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。

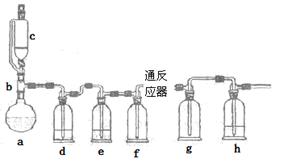
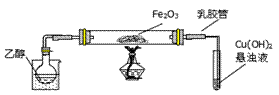
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。

①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
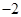 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:

 =
=
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。

(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。

①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
(19分)
(1)坩埚(2分)
(2)漂白(2分);氧化(2分)
(3)①MnO2+4H++2Cl? Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
③关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。(3分)
④否(1分),在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的。(2分)
(4)92%(2分)
(1)坩埚(2分)
(2)漂白(2分);氧化(2分)
(3)①MnO2+4H++2Cl?
 Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)
Mn2++Cl2↑2H2O(3分)②b→c→g→h→d(2分)③关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。(3分)
④否(1分),在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的。(2分)
(4)92%(2分)
试题分析:(1)固体的焙烧在坩埚内进行。
(2)SO2通入品红溶液,证明SO2具有漂白性;SO2通入H2S溶液,生成S淡黄色沉淀,证明SO2具有氧化性。
(3)①MnO2与浓盐酸反应生成Cl2、MnCl2、H2O。离子方程式为:MnO2+4H++2Cl?
 Mn2++Cl2↑2H2O
Mn2++Cl2↑2H2O②生成的Cl2含有HCl、H2O,所以a连接b、c,通过饱和食盐水除去HCl、继续连接g、h,通过浓硫酸,除去H2O,再连接d,即可收集纯净、干燥的氯气。
③利用加热气体膨胀的原理进行装置气密性的检验,所以检验方法为:关闭分液漏斗的活塞,将导管插入水中,微热圆底烧瓶,若导管末端产生气泡,停止加热,导管中有一段水柱形成,说明装置不漏气。
④因为该检验方法是先通入氯气,再滴加KSCN溶液,在通氯气前滤液A中就可能含有Fe3+,无法确定Fe3+一定是Fe2+被Cl2氧化得来的,所以该实验设计不合理。
(4)根据Fe元素守恒可得:2CuFeS2~ Fe2O3,所以该黄铜矿中含CuFeS2的质量分数=8g×368/160÷20g×100%=92%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

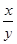 =_____。
=_____。