题目内容
(12分)实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
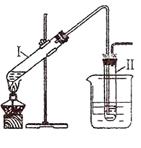
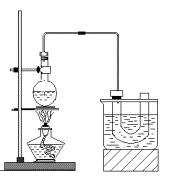
(Ⅰ)用右图所示的装置制取溴乙烷:
在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入冰水。加热试管I至微沸状态数分钟后,冷却。
(1)试管I中生成溴乙烷的化学反应方程式为: 。
(2) 试管I中加入2 mL 的蒸馏水,其作用除溶解NaBr粉末和吸收HBr气体之外还有一个重要作用是 _____ 。
(3)反应结束后,试管Ⅱ中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 __________(填字母)
(4)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后____________________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(Ⅱ)溴乙烷的性质实验
(5)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过右图所示的装置。用该装置进行实验的目的是检验乙烯的生成,该图中右边试管中的现象是 ;左边试管中水的作用是 。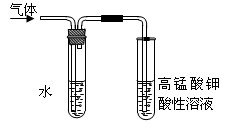

(Ⅰ)用右图所示的装置制取溴乙烷:
在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入冰水。加热试管I至微沸状态数分钟后,冷却。
(1)试管I中生成溴乙烷的化学反应方程式为: 。
(2) 试管I中加入2 mL 的蒸馏水,其作用除溶解NaBr粉末和吸收HBr气体之外还有一个重要作用是 _____ 。
(3)反应结束后,试管Ⅱ中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 __________(填字母)
| A.NaOH溶液 | B.H2O | C.Na2SO3溶液 | D.CCl4 |
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(Ⅱ)溴乙烷的性质实验
(5)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过右图所示的装置。用该装置进行实验的目的是检验乙烯的生成,该图中右边试管中的现象是 ;左边试管中水的作用是 。

(1)C2H5OH + HBr 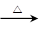 C2H5Br + H2O;(2)降低浓硫酸的氧化性,减少副反应;
C2H5Br + H2O;(2)降低浓硫酸的氧化性,减少副反应;
(3)C (4)④①⑤③②。 (5)酸性高锰酸钾褪色;除去乙醇等杂质等干扰
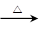 C2H5Br + H2O;(2)降低浓硫酸的氧化性,减少副反应;
C2H5Br + H2O;(2)降低浓硫酸的氧化性,减少副反应;(3)C (4)④①⑤③②。 (5)酸性高锰酸钾褪色;除去乙醇等杂质等干扰
(1)乙醇和溴化氢发生取代反应,即得到溴乙烷,方程式为C2H5OH + HBr 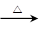 C2H5Br + H2O。
C2H5Br + H2O。
(2)由于浓硫酸具有强氧化性和脱水性,所以利用水的稀释,降低浓硫酸的氧化性,减少副反应的发生。
(3)C2H5Br呈棕黄色是因为含有单质溴,A中氢氧化钠能和溴乙烷反应,所以应该选择亚硫酸钠,利用亚硫酸钠的还原性除去单质溴,四氯化碳易溶在溴乙烷中,不能选择,答案选C。
(4)要检验溴乙烷中的溴元素,应该显使溴乙烷水解,然后在加入硝酸银溶液。由于水解需要在碱性条件下进行,而溴离子和硝酸银的反应需要在酸性条件下,所以再加入硝酸银溶液之前应该先加入酸进行酸化,所以正确的顺序是④①⑤③②。
(5)乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色。由于乙醇易挥发,生成的乙烯中混有乙醇,而乙醇也能使酸性高锰酸钾溶液褪色,所以边试管中水的作用是除去乙醇等杂质等干扰。
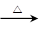 C2H5Br + H2O。
C2H5Br + H2O。(2)由于浓硫酸具有强氧化性和脱水性,所以利用水的稀释,降低浓硫酸的氧化性,减少副反应的发生。
(3)C2H5Br呈棕黄色是因为含有单质溴,A中氢氧化钠能和溴乙烷反应,所以应该选择亚硫酸钠,利用亚硫酸钠的还原性除去单质溴,四氯化碳易溶在溴乙烷中,不能选择,答案选C。
(4)要检验溴乙烷中的溴元素,应该显使溴乙烷水解,然后在加入硝酸银溶液。由于水解需要在碱性条件下进行,而溴离子和硝酸银的反应需要在酸性条件下,所以再加入硝酸银溶液之前应该先加入酸进行酸化,所以正确的顺序是④①⑤③②。
(5)乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色。由于乙醇易挥发,生成的乙烯中混有乙醇,而乙醇也能使酸性高锰酸钾溶液褪色,所以边试管中水的作用是除去乙醇等杂质等干扰。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
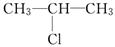
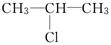 和NaOH乙醇溶液共热发生反应的化学方程式为:_____,反应类型为________.
和NaOH乙醇溶液共热发生反应的化学方程式为:_____,反应类型为________. 某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。 ,A分子中最多在同一平面的原子数为 ;
,A分子中最多在同一平面的原子数为 ; ,写出此化合物的结构简式 ;
,写出此化合物的结构简式 ;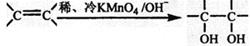 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式 ;