题目内容
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
A
解析试题分析:X、Y、Z、W、R五种短周期元素,五种元素原子序数依次增大。X原子是所有原子中半径最小的,则X是H元素;Y原子的最外层电子数是次外层的3倍,则Y是O元素;由于Y、R同主族,所以R是S元素;Z、W、R同周期, Z是常见的金属,电子层数等于主族序数,则Z是Al元素,W单质是人类将太阳能转变为电能的常用材料。则W是Si。综上所述,X是H;Y是O;Z是Al;W是Si;R是S。A. Z与Y形成的化合物Al2O3是离子化合物,熔化需要断裂离子键,而离子键是一种强烈的相互作用,断裂要消耗很高的能量,所以可作为耐高温材料。正确。B.SiO2是酸性氧化物,能与碱反应产生盐和水,也可以与HF发生反应SiO2+4HF=SiF4+2H2↑。因此错误。C.同周期的元素的原子半径随核电荷数的增大而减小,不同周期的元素的原子半径,原子核外的电子层数越多,原子半径越大。所以,这五种元素的原子半径:Al>Si>S>O>H。错误。D.由于在水的分子之间存在着氢键,所以增加了分子之间的相互作用,使得水的熔点、沸点比H2S高。错误。
考点:考查元素的推断及元素周期表、元素周期律的应用的知识。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案下列说法正确的是
| A.电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
Y元素最高正价与负价的绝对值之差为4,Y元素与M元素可形成离子化合物,该物质能溶于水并在水中电离出电子层结构相同的离子,该化合物是
| A.硫化钾 | B.硫化钠 | C.氯化钠 | D.氧化铝 |
下列关于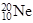 和
和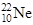 的说法正确的是
的说法正确的是
| A.质量数相同 | B.中子数相同 | C.互为同位素 | D.核外电子数不同 |
由短周期元素和长周期元素共同组成的族可能是
| A.主族 | B.副族 | C.Ⅷ族 | D.Ⅶ族 |
2012年,IUPAC正式命名了116号元素,下列关于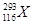 和
和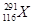 的说法中,错误的是
的说法中,错误的是
| A.这是两种原子 |
| B.两者电子数相差1 |
| C.两种原子中中子数分别为177和175 |
| D.两者互为同位素 |
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
| | 甲 | |
| | | |
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
依据元素周期表及元素周期律,下列推断中正确的是( )
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |