题目内容
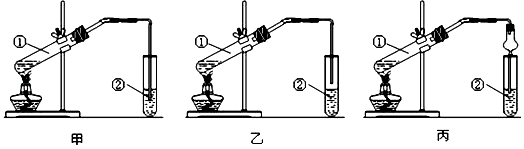
【题目】已知:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
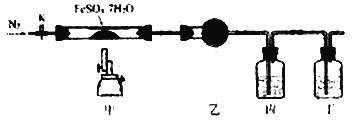
A. 乙、丙、丁中可依次盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
【答案】A
【解析】A、丙装置验证的是SO3,因为NO3-在酸性条件下具有强氧化性,能把SO2氧化成SO42-,对SO3的检验产生干扰,丙装置应换成BaCl2溶液,故A说法错误;B、先通N2,排除装置中空气,防止Fe2+被氧化,故B说法正确;C、残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红说明溶液中含有Fe3+,反之不含有,故C说法正确;D、SO2有毒,为防止污染空气,因此在丁装置后面再加一尾气处理装置,即添加盛有NaOH溶液的洗气瓶,故D说法正确。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=﹣1 200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).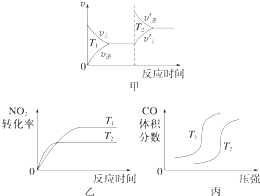
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.
820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为 .
②平衡时,甲容器中CO的转化率是 . 比较下列容器中CO的转化率:乙甲;丙甲(填“>”、“=”或“<”).
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度(填“升高”或“降低”),平衡常数K(填“增大”、“减小”或“不变”).