题目内容
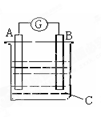
如图示的原电池中,

(1)铜极为原电池的 (填“正”或“负”)极,该极的电极反应式是 ,属于 (填“氧化反应”或“还原反应”)。
(2)如铁棒质量减轻5.6 g,则另一极放出气体的体积为 L(标准状况)。

(1)铜极为原电池的 (填“正”或“负”)极,该极的电极反应式是 ,属于 (填“氧化反应”或“还原反应”)。
(2)如铁棒质量减轻5.6 g,则另一极放出气体的体积为 L(标准状况)。
(每空2分) (1)正 2H+ + 2e-= H2↑ 还原反应 (2)2.24L
试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铁比铜活泼,所以铁是负极,铜是正极,溶液中的氢离子在正极得到电子,正极电极反应式是2H+ + 2e-= H2↑。
(2)如铁棒质量减轻5.6 g,即消耗铁的物质的量是0.1mol,失去0.2mol电子,所以根据电子的得失守恒可知,另一极放出气体的体积为0.2mol÷2×22.4L/mol=2.24L。
点评:该题是中等难度试题的考查,主要是检验学生对原电池原理的熟悉了解程度,意在巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力,难度不大,记住原电池工作原理,并根据电子的得失守恒进行计算即可。

练习册系列答案
相关题目