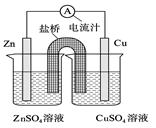
题目内容
将银棒和锌棒用导线连接插入AgNO3溶液中,当导线中有0.2 mol电子通过时,负极质量的变化是( )
| A.增加6.5 g | B.减少6.5 g | C.增加21.6g | D.减少21.6g |
B
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比银活泼,所以锌是负极,失去电子。银是正极,溶液中的银离子得到电子。当导线中有0.2 mol电子通过时,负极质量的变化是减少0.1mol×65g/mol=6.5g,答案选B。
点评:该题主要是考查学生对原电池原理的熟悉了解程度,意在检验学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理,并能结合题意灵活运用即可。有利于培养学生的逻辑推理能力和发散思维能力,提高学生的应试能力。

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目


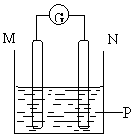
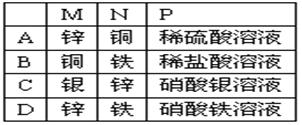
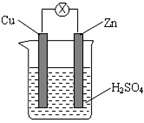
 Zn
Zn