题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察 ,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理,其理由是 。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是 。
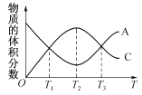
(3)将0.10 mol MnO2粉末加入到50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。

①写出H2O2在MnO2作用下发生反应的化学方程式: 。
②计算H2O2的初始物质的量浓度为 。(请保留两位有效数字)
【答案】(1)产生气泡的快慢(2分) 消除阴离子不同对实验的干扰(2分)
(2)关闭分液漏斗的活塞,将注射器活塞向外拉出一段松手,过一会儿观察其是否回到原位置(2分)产生40 mL气体所需的时间(2分)
(3)①2H2O2![]() 2H2O+O2↑(2分) ②0.089 mol·L-1(3分)
2H2O+O2↑(2分) ②0.089 mol·L-1(3分)
【解析】(1)可以通过观察产生气泡的快慢来定性分析,将CuSO4改为CuCl2更为合理,原因是排除了阴离子不同造成的干扰,实验更加严密。(2)既然是测定反应速率,必须知道反应的时间。(3)氧气的体积为50 mL,则n(O2)=![]() ,所以n(H2O2)=
,所以n(H2O2)= ![]() ,浓度为
,浓度为![]() =0.089 mol·L-1。
=0.089 mol·L-1。

练习册系列答案
相关题目