题目内容
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
【答案】
(2)①2CrO42-+2H+![]() Cr2O72-+H2O; ② 增大;1.0×1014 ;③小于;
Cr2O72-+H2O; ② 增大;1.0×1014 ;③小于;
【解析】
试题分析: (2)①随着H+浓度的增大,CrO42-于溶液的H+发生反应,反应转化为Cr2O72-的离子反应式为:2CrO42-+2H+![]() Cr2O72-+H2O。②根据化学平衡移动原理,溶液酸性增大,c(H+)增大,化学平衡2CrO42-+2H+
Cr2O72-+H2O。②根据化学平衡移动原理,溶液酸性增大,c(H+)增大,化学平衡2CrO42-+2H+![]() Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25mol/L,由于开始时c(CrO42)=1.0mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5mol/L;H+浓度为1×10-7mol/L;此时该转化反应的平衡常数为
Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25mol/L,由于开始时c(CrO42)=1.0mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5mol/L;H+浓度为1×10-7mol/L;此时该转化反应的平衡常数为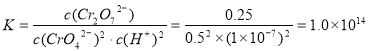 ;③由于升高温度,溶液中CrO42的平衡转化率减小,说明升高温度,化学平衡逆向移动,导致溶液中CrO42的平衡转化率减小,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故该反应的ΔH<0;
;③由于升高温度,溶液中CrO42的平衡转化率减小,说明升高温度,化学平衡逆向移动,导致溶液中CrO42的平衡转化率减小,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故该反应的ΔH<0;