题目内容
【题目】高氯酸钠可以用于制备火箭推进剂高氯酸铵。以粗盐为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
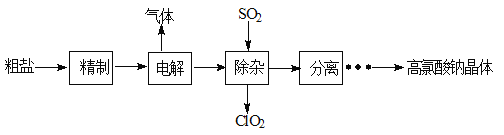
(1)“精制”中,由粗盐(含Ca2+、Mg2+、SO42-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。加入Na2CO3溶液的作用
(2)“电解”分2步进行,其反应分别为NaCl+3H2O![]() NaClO3+3H2↑ NaClO3+H2O
NaClO3+3H2↑ NaClO3+H2O![]() NaClO4+H2↑
NaClO4+H2↑
(3)“除杂”的目的是除去少量未被电解的NaClO3,该反应的化学方程式为: ,
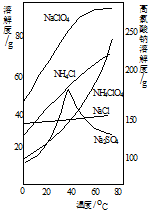
(4)“分离”的操作分别是加热浓缩、 、冷却结晶、过滤、洗涤、干燥。(各物质的溶解度如右图所示)
(5)室温下将得到的高氯酸钠晶体加入氯化铵饱和溶液中,反应的离子方程式为:
(6)为确定所得高氯酸钠晶体的纯度(含有少量Na2SO4杂质),进行如下实验:
①准确称取3.00 g样品加水充分溶解,所得溶液转移至容量瓶并配置成100 mL溶液。
②量取25.00 mL溶液,加入足量的KI溶液充分反应(ClO4-被还原成Cl-),再滴加1.000 mol·L-1 Na2S2O3溶液进行反应(反应为I2+2 Na2S2O3=2 NaI+ Na2S4O6),恰好消耗40.00 mL Na2S2O3溶液。
根据以上数据计算样品中高氯酸钠晶体纯度为: (写出计算过程,保留四位有效数字)
【答案】(1)除去Ca2+和过量的Ba2+
(3)2NaClO3+SO2=2ClO2+Na2SO4
(4)趁热过滤(5)ClO4-+ NH4+ =NH4ClO4↓
(6)93.67%
【解析】
试题分析:(1)在粗盐精制的操作中,加入的碳酸钠要放在加入氯化钡溶液之后,这样碳酸钠会与Ca2+反应生成碳酸钙,也会除去反应剩余的氯化钡,所以加入Na2CO3溶液的作用是除去Ca2+和过量的Ba2+ 。
(3)根据流程图可以看出,SO2与NaClO3反应生成ClO2和Na2SO4,反应的化学方程式为2NaClO3+SO2=2ClO2+ Na2SO4 。
(4)根据各物质的溶解度示意图可知,高氯酸钠的溶解度随温度的变化较大,则由溶液得到高氯酸钠晶体(NaClO4·H2O)的操作为加热浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥等。
(5)因为室温下,高氯酸铵的溶解度较小,所以将高氯酸钠晶体加入到氯化铵饱和溶液中生成高氯酸铵晶体,反应的离子方程式为ClO4-+ NH4+ =NH4ClO4↓。
(6)25ml溶液中,
NaClO4·H2O ~4I2 ~ 8Na2S2O3
1 8
n (NaClO4)=5×10-3mol 4×10-2 mol
3.0g样品中含n (NaClO4·H2O)=5×10-3mol×4=2×10-2mol
3.0g样品中m (NaClO4·H2O)= 2×10-2mol×140.5g·mol -=2.81g
3.0g样品中w (NaClO4·H2O)=93.67%

【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
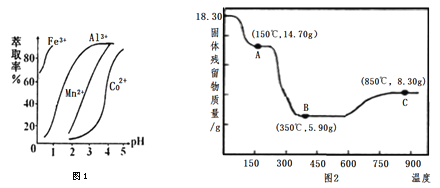
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。