题目内容
【题目】现有一瓶含NaCl杂质的Na2CO3样品,某同学设计了一种测定其纯度的方法,装置如下图,其中A容器中盛有样品10.0 g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。
(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,可是结果数据出现了较大偏差(容器内反应均完全,装置内空气的影响忽略不计),请你分析可能的原因______。


(2)通过仔细分析,该同学重新设计了一套实验装置如下图,请回答有关问题:
(可供选择的试剂还有Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)
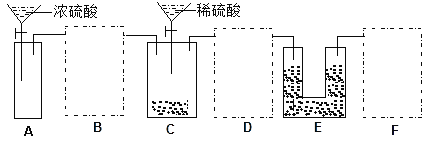
①该套装置未画完整,请在你认为需要补充装置的虚框内画出合适的简图,并注明试剂。______
②A装置的广口瓶中应加入的试剂是__________;该装置的作用是________________。
③如果实验后测得E装置质量增重3.52 g,则该Na2CO3试样的纯度为__________。
(3)测定该Na2CO3试样纯度的方法有多种,请你利用不同的反应原理再设计一套方案。
要求写出实验操作流程和试样中Na2CO3纯度的表达式__________。(试剂任选)
操作流程按下列图示表述:
![]()
①操作流程为:
![]()
②实验时称量样品的质量为a克,所测物质的质量为b克,该试样中Na2CO3纯度的表达式为:__________。
【答案】 A中产生的CO2气体未全部进入B;CO2中混有的少量水蒸气进入B;B吸收了空气中的水蒸气、CO2。  Zn片和蒸馏水 利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收 84.8%
Zn片和蒸馏水 利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收 84.8% 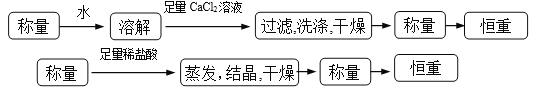 53b/50a 或106(b-a)/11a
53b/50a 或106(b-a)/11a
【解析】(1)该同学重复操作了三次,每次操作均正确,且装置不漏气,排除了偶然误差的可能,可是结果数据出现了较大偏差,说明实验方案的设计有缺陷。首先分析A装置,发现没有将其中产生的CO2气体全部排出进入B的措施;再分析A中产生的CO2,其中肯定会混有的少量水蒸气随CO2进入B被碱石灰一起吸收;B吸收了空气中的水蒸气、CO2。
(2).针对上面分析的设计缺陷,根据所提供的药品和试剂,可以先用硫酸和锌制取氢气通入C装置,将C装置产生的二氧化碳全部排出经盛有浓硫酸的洗气瓶D装置干燥后再通入E被碱石灰吸收,为防止E吸收空气中的二氧化碳和水蒸气,在E后面加装一个和E相同的装置F,①图示如下:
②A装置是制取氢气用的,实验室通常用锌和稀硫酸反应制氢气,所以广口瓶中应加入的试剂是Zn片和蒸馏水;该装置的作用是利用A中生成的H2 将C中的CO2全部排入E中被碱石灰吸收。
③如果实验后测得E装置质量增重3.52 g,则二氧化碳的质量为3.52 g,其物质的量为0.08mol,因为反应前后碳原子守恒可知样品中碳酸钠的物质的量是0.08mol,所以该Na2CO3试样的纯度为![]()
![]() =84.8% 。
=84.8% 。
(3). 方案一:可以称量样品质量a g,加水将其充分溶解后,向所得水溶液中加入稍过量的氯化钙溶液,过滤,用少量蒸馏水洗涤沉淀2~3次,再将碳酸钙沉淀干燥后称重。方案二:可以称量样品质量a g,加足量稀盐酸将样品充分溶解后,将溶液蒸发结晶得到氯化钠晶体,晶体经干燥后称重。①流程如下: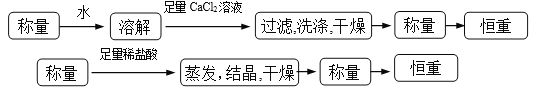 (4). ②方案一:由沉淀碳酸钙的质量b g可求出碳酸钠的物质的量为
(4). ②方案一:由沉淀碳酸钙的质量b g可求出碳酸钠的物质的量为![]() mol,碳酸钠的质量为 53b/50g,所以碳酸钠的质量分数为53b/50a 。
mol,碳酸钠的质量为 53b/50g,所以碳酸钠的质量分数为53b/50a 。
方案二: Na2CO3 ~ 2NaCl ~ △m
106 117 11
m (b-a)g
列比例式求出m=106(b-a)/11 g
所以碳酸钠的质量分数为106(b-a)/11a

 阅读快车系列答案
阅读快车系列答案