题目内容
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l) ΔH=-131.0 kJ·mol-1 ;
CH3OH(l)+H2O(l) ΔH=-131.0 kJ·mol-1 ;
H2(g)+O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1。
CH3OH的燃烧热ΔH=_______________。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)![]() CH3COOH(g) ΔH=+36.0 kJ·mol-1。在不同温度下乙酸的生成速率变化如右图所示。
CH3COOH(g) ΔH=+36.0 kJ·mol-1。在不同温度下乙酸的生成速率变化如右图所示。

① 当温度在250 ℃~300 ℃范围时,乙酸的生成速率减慢的主要原因是___________,当温度在300 ℃~400 ℃范围时,影响乙酸生成速率的主要因素是___________________。
② 欲使乙酸的平衡产率提高,应采取的措施是___________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g) ![]() 2CO(g)。
2CO(g)。
① 向容积为1 L的恒容容器中加入0.2 mol CO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示。

则该反应为___________(填“放热”或“吸热”)反应,某温度下,若向该平衡体系中再通入0.2 mol CO2,平衡___________(填“正向”“逆向” “不”)移动,达到新平衡后,体系中CO的百分含量__________(填“变大” “变小”“不变”)。
② 向压强为p体积可变的恒压容器中充入一定量CO2,650 ℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________________。气体分压(p分)=气体总压(p总)体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=__________________________(用含p的代数式表示),若向平衡体系中再充入V(CO2):V(CO)=5:4的混合气体,平衡___________(填“正向”“逆向”“不”)移动。
【答案】 -726.4 kJ/mol 催化剂活性降低 温度 A C 吸热 正向 变小 25% 4P/15 (或0.267P) 逆向
【解析】(1)①CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l) ΔH=-131.0 kJ·mol-1;②H2(g)+O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1,根据盖斯定律,将②×3-①得:CH3OH(l)+ 3O2(g)= CO2(g)+ H2O(l),ΔH=(-285.8 kJ·mol-1)×3-(-131.0 kJ·mol-1)=-726.4 kJ/mol,故答案为:-726.4 kJ/mol;
CH3OH(l)+H2O(l) ΔH=-131.0 kJ·mol-1;②H2(g)+O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1,根据盖斯定律,将②×3-①得:CH3OH(l)+ 3O2(g)= CO2(g)+ H2O(l),ΔH=(-285.8 kJ·mol-1)×3-(-131.0 kJ·mol-1)=-726.4 kJ/mol,故答案为:-726.4 kJ/mol;
(2)① 当温度在250 ℃~300 ℃范围时,催化剂活性降低,乙酸的生成速率减慢,当温度在300 ℃~400 ℃范围时,乙酸的生成速率加快,说明影响乙酸生成速率的主要因素是温度,故答案为:催化剂活性降低;温度;
②该反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高,故A正确,B错误;该反应为气体体积减小的反应,增大压强,平衡正向移动,乙酸的平衡产率提高,故C正确,D错误;故选AC;
(3)①根据图像,升高温度,c(CO2)减小,说明平衡正向移动,则正反应为吸热反应,某温度下,若向该平衡体系中再通入0.2 mol CO2,增大了二氧化碳的浓度,平衡正向移动,达到新平衡后,相当于原平衡增大了压强,平衡逆向移动,体系中CO的百分含量减小,故答案为:吸热;正向;变小;
②设起始时二氧化碳为xmol,反应的二氧化碳为ymol
C(s)+CO2(g) ![]() 2CO(g)
2CO(g)
起始(mol) x 0
反应(mol) y 2y
平衡(mol) x-y 2y
则![]() ×100%=40.0%,解得
×100%=40.0%,解得![]() =
=![]() =25%;设y=1mol,则x=4mol,因此二氧化碳的平衡分压为
=25%;设y=1mol,则x=4mol,因此二氧化碳的平衡分压为![]() P,CO的平衡分压为
P,CO的平衡分压为![]() P,化学平衡常数Kp=
P,化学平衡常数Kp=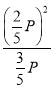 =
=![]() P;平衡时V(CO2):V(CO)=3:2,若向平衡体系中再充入V(CO2):V(CO)=5:4<3:2,则平衡逆向移动,故答案为:25%;4P/15;逆向。
P;平衡时V(CO2):V(CO)=3:2,若向平衡体系中再充入V(CO2):V(CO)=5:4<3:2,则平衡逆向移动,故答案为:25%;4P/15;逆向。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】下表是元素周期表的一部分,请按要求回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素的原子结构示意图为:;
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应的水化物反应的离子方程式:;
(3)元素④与元素⑦形成的化合物中的化学键类型是 , 写出该化合物的电子式:;
(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中酸性最弱的是(填化学式);
(5)元素③与元素⑩两者核电荷数之差是;
(6)气态氢化物能与其最高价氧化物对应的水化物反应生成盐的元素是:(填序号);
(7)④⑤⑥⑦四种元素的简单离子的半径由大到小的顺序为:(填化学式).
